BIOLOGIJA
Potraga za zajedničkim svojstvima svih tumora. Ideal pronalaska univerzalnog lijeka
 Tamara Čačev / 29. travnja 2023. / Članci / čita se 20 minuta
Tamara Čačev / 29. travnja 2023. / Članci / čita se 20 minuta
 Tamara Čačev / 29. travnja 2023. / Članci / čita se 20 minuta
Tamara Čačev / 29. travnja 2023. / Članci / čita se 20 minuta

Ubrzani napredak u razumijevanju etiologije tumora započeo je prije tri do četiri desetljeća s razvojem molekularnih bioznanosti. Tamara Čačev u svojem pregledu aktualnih spoznaja popisuje sve zajedničke karakteristike tumora koje smo do danas identificirali, te objašnjava zašto je još uvijek nemoguće pronaći "lijek za rak", panaceu koja bi djelovala na sve oblike ove maligne bolesti.
Borba protiv tumorskih bolesti prati nas oduvijek. Već se u najstarijim egipatskim zapisima mogu pronaći opisi bolesti koje danas prepoznajemo kao opise tumora dojke. Nalazi mumificiranih tijela iz očuvanih egipatskih grobnica također ukazuju da su i tadašnji ljudi bolovali od tumora kostiju te tumora glave i vrata. Tumori su nažalost cijena koju plaćamo za naš napredak i specijalizaciju koja proizlazi iz činjenice da smo višestanični organizmi. Jednostanični organizmi poput bakterija sve svoje nose sa sobom u jednoj stanici i kada se podijele, nastaju dvije jedinke od kojih svaka nastavlja svojim putem, stihijski, kako ih uvjeti okoliša nanesu. Njihova evolucijska strategija je brzo umnažanje i brojnost. No, zato niti jedna bakterija, iako će možda preživjeti nuklearnu kataklizmu ili udar meteora, nije razvila nešto poput umjetne inteligencije. Za to naravno najprije treba razviti vlastitu, a to je teško, čak i kad imamo specijalizirane stanice živčanog sustava.
Višestaničnost je omogućila organizmima da se pojedine skupine stanica specijaliziraju (diferenciraju) za točno određene uloge u organizmu. Zatim se skupine takvih stanica ujedinjuju u tkiva poput epitelnog, vezivnog, živčanog ili mišićnog tkiva kako je to slučaj kod životinja. U konačnici, kompleksniji sustavi više tipova stanica s istom objedinjenom namjenom tvore organe i organske sustave. Na isti način se odvijala i evolucija u biljnom svijetu gdje su određene stanice i tkiva preuzimale specifične funkcije unutar biljnog organizma. No, u tako specijaliziranim sustavima, stanice se neminovno troše i treba ih nadomjestiti novim, a stare, nefunkcionalne stanice na siguran način ukloniti. To posebno dolazi do izražaja kod tkiva koje su kontaktu s okolinom poput kože ali i probavnog sustava koji je također prvo mjesto doticaja svega što unosimo hranom i pićem u organizam. Obnova stanica pak znači da kontinuirano mora postojati određeni broj matičnih stanica iz kojih će diobom nastati zamjenske diferencirane stanice. To također znači da mora postojati i učinkovit sustav uklanjanja amortiziranih stanica. Nadomještanje starih stanica novima je vrlo striktno reguliran i kontroliran proces u kojem sudjeluje mnoštvo molekularnih signalnih puteva. No, ukoliko dođe do poremećaja funkcije nekog od njih kroz mutacije ili poremećenu epigenetsku regulaciju tada se otvaraju vrata hiperproliferaciji stanica izvan okvira onog koji je potreban za nadomještanje. Također se otvara mogućnost zadržavanja oštećenih stanica u tkivima i to su zapravo mehanizmi koji otvaraju vrata nastanku tumora.

Moderno razumijevanje etiologije većine bolesti pa tako i tumora započinje negdje u vrijeme Rudolfa Virchowa (1821-1902), oca moderne patologije koji je prvi postulirao kako u korijenu svake bolesti leži neka patološka promjena na razini stanica koje tvore tkivo i organ koji je zahvaćen bolešću. Kako je dakle svaka bolest u osnovi rezultat nekog poremećaja na razini regulacije molekula u stanicama i tkivima jasno je da su se značajniji iskoraci u razumijevanju etiologije mnogih bolesti pa tako i tumorskih mogli napraviti tek razvojem molekularnih bioznanosti. Nakon razvoja metoda umnažanja DNA (PCR) i sekvenciranja DNA došlo je do ekspanzije istraživanja u svim područjima biologije pa tako i u istraživanju nastanka i napredovanja tumora sve do današnjeg dana kada u najprestižnijim svjetskim bolnicama (ali sve više i u svakodnevnoj primjeni) svjedočimo personaliziranom pristupu svakom oboljelom u dijagnostici i terapiji na temelju molekularnog profila njegovog tumora.
Što smo naučili u ovih 30-40 g intenzivnog istraživanja molekularne etiologije tumora? Jesmo li pametniji i uspješniji u njihovom dijagnosticiranju i terapiji? O tome govore ponajprije epidemiološke statistike koje pokazuju kako je prevencija i rana dijagnostika i dalje alfa i omega svake uspješne borbe s ovom bolešću. I dalje vrijedi bolje spriječiti nego liječiti no čak i kad napravimo sve što je u našoj moći a vezano je uz naš način života i izloženost štetnostima iz okoliša od čega je na daleko vodećem mjestu pušenje koje doprinosi gotovo svakoj kroničnoj nezaraznoj bolesti, ipak postoji faktor stohastičkih grešaka tijekom diobe stanica koje se događaju i ispravljaju svaki dan našeg života.
Mnoge premaligne stanice se uspješno eliminiraju svakodnevno iz našeg organizma vlastitim mehanizmima, no kako se životni vijek produljuje to ujedno znači i više staničnih dioba i veću mogućnost grešaka kao i mogućnosti da one ne budu ispravljene. Zanimljivo jest da kod osoba koje nemaju očitu nasljednu komponentu za obiteljsku predispoziciju prema nekom tipu tumora prosječna dob kada se tumori dijagnosticiraju jest oko 65. godine. Smatra se da je upravo to vrijeme koje je potrebno da bi se u nekoj stanici u kojoj se dogodila početna molekularna promjena (npr. mutacija) akumuliralo dovoljno daljnjih promjena da ona maligno alterira i nekontroliranim diobama stvori tumor. Naravno, prijespomenuta dob je rezultat epidemiološke statistike, no jasno je da se tumori mogu javiti bilo kad tijekom života, dok posebno zabrinjava opažanje da se maligne bolesti sve češće javljaju kod mlađih i ljudi srednjih godina.

Danas mnogo desetina tisuća znanstvenika diljem svijeta radi u području molekularne onkologije te se postavlja pitanje jesmo li napredovali u razumijevanju nastanka i napredovanja tumorskih bolesti? Odgovor su na prijelazu 20. u 21. stoljeće pokušali dati Douglas Hanahan (Swiss Federal Institute of Technology, Lausanne, Švicarska) i Robert Weinberg (Whitehead Institute for Biomedical Research i Massachusetts Institute of Technology, SAD) u svojem amblematskom preglednom radu The Hallmarks of Cancer u prestižnom časopisu Cell, koji je do danas citiran više od 40 tisuća puta.1
Iako je ideja o stupnjevitoj progresivnoj tumorigenezi tijekom koje se normalna stanica pretvara u tumorsku postojala i prije, te su opisani i modeli kako do toga dolazi primjerice u tumorima debelog crijeva kako su to prikazali Eric Fearon i Bert Vogelstein još 1990. godine (slika 1), Hanahan i Weinberg su stupnjevitu tumorigenezu opisali na univerzalnijoj razini primjenjivoj na gotovo sve (solidne) tumore. Predložili su model u kojem stanica od normalne progredira ka neoplastičnoj i konačno metastatskoj kroz stjecanje specifičnih svojstava koja su karakteristika tumorskih stanica i nazvali su ih „the hallmarks of cancer“ odnosno karakterističnim obilježjima tumorskih stanica.
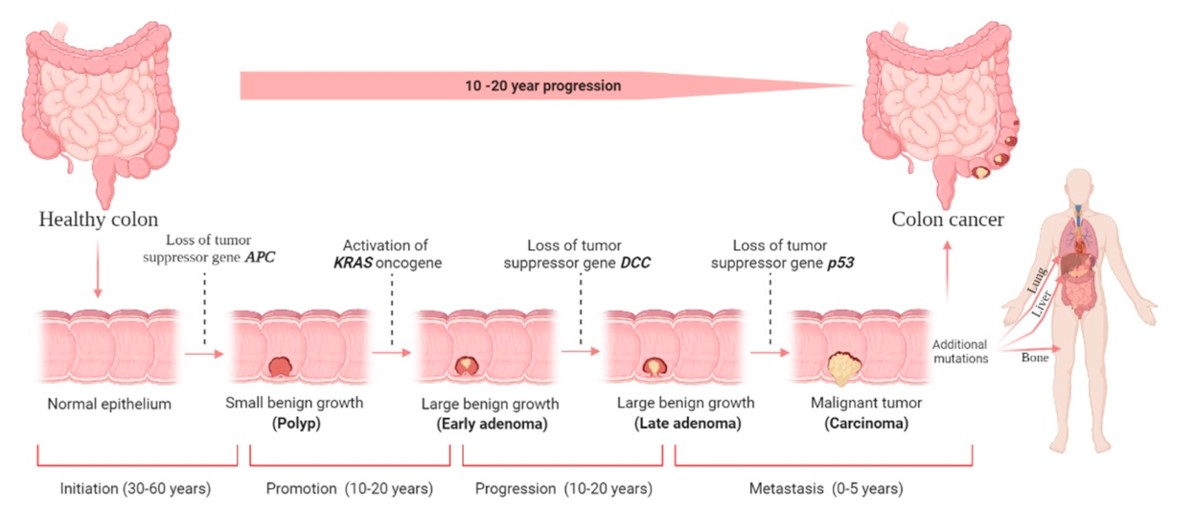 Slika 1. Fearon-Vogelsteinov model nastanka i napredovanja tumora debelog crijeva. Preuzeto iz Hossain MS i sur. Colorectal Cancer: A Review of Carcinogenesis, Global Epidemiology, Current Challenges, Risk Factors, Preventive and Treatment Strategies. Cancers (Basel). 2022;14(7):1732.
Slika 1. Fearon-Vogelsteinov model nastanka i napredovanja tumora debelog crijeva. Preuzeto iz Hossain MS i sur. Colorectal Cancer: A Review of Carcinogenesis, Global Epidemiology, Current Challenges, Risk Factors, Preventive and Treatment Strategies. Cancers (Basel). 2022;14(7):1732.Kako jedna obična, normalna stanica može maligno alterirati i postati tumorska? Ako se prisjetimo da tumor nastaje nekontroliranom diobom stanica te neadekvatnim odstranjivanjem oštećenih stanica zbog čega dolazi do akumulacije mutacija koje daju dodatne sposobnosti tako izmijenjenoj stanici, jasno je da su ključna svojstva koje tumorske stanice moraju steći tijekom progresije tumora: kontinuiranost signala za diobu, sposobnost izbjegavanja kontrolnih točaka gdje bi se ta dioba i rast mogli zaustaviti, izbjegavanje stanične smrti kao mehanizma odstranjivanja oštećenih stanica, postizanje beskonačne diobe odnosno replikativne besmrtnosti, poticanje nastanka novih krvnih žila kako bi se osigurao dotok hranjivih tvari i kisika u tumor te aktivacija invazivnih karakteristika tumorskih stanica koje će im omogućiti širenje u okolno tkivo te dalje metastatski po organizmu.
U svakom tipu tumora pa čak i kod osoba oboljelih od istog tipa premaligna stanica može steći ova svojstva akumulacijom mutacija. Pri tome se može raditi o mutacijama različitih gena no ono što je bitno jest da će njihova funkcija svakako biti vezana za neku od prije navedenih temeljnih karakteristika svakog tumora. Također, moguće je da će tijekom nastanka i napredovanja tumora redoslijed događanja odnosno molekularnih promjena biti možda vremenski drugačiji, no na kraju će svaki solidni tumor morati proći kroz ove ključne faze nastanka i napredovanja (slika 2).
Dakle, vrsta i redosljed mutacija u različitim tipovima tumora pa čak i u istom tipu tumora između pojedinaca mogu se razlikovati, no bitno jest da se nalaze u genima signalnih puteva koji imaju ulogu u stjecanju neke od navedenih tumorskih karakteristika. Ovo su ujedno i razlozi zašto ne postoji univerzalni „lijek za rak“, molekula koja bi „gađala“ Ahilovu petu svih tumora. Naravno, možemo reći kako su najstarije, a ujedno počesto i dalje najučinkovitije kemoterapije one koje ubijaju tumorsku stanicu golom silom donekle univerzalne, no one nisu ciljane te ako stremimo ka tome da tumorske bolesti postanu kronične bolesti s kojima živimo, što je već danas slučaj za mnoge tipove tumora, tada je jasno da moramo razviti više linija obrane od tumora kako bismo imali rješenja za pojavu rezistencije koja neminovno nastaje kako tumor evoluira.
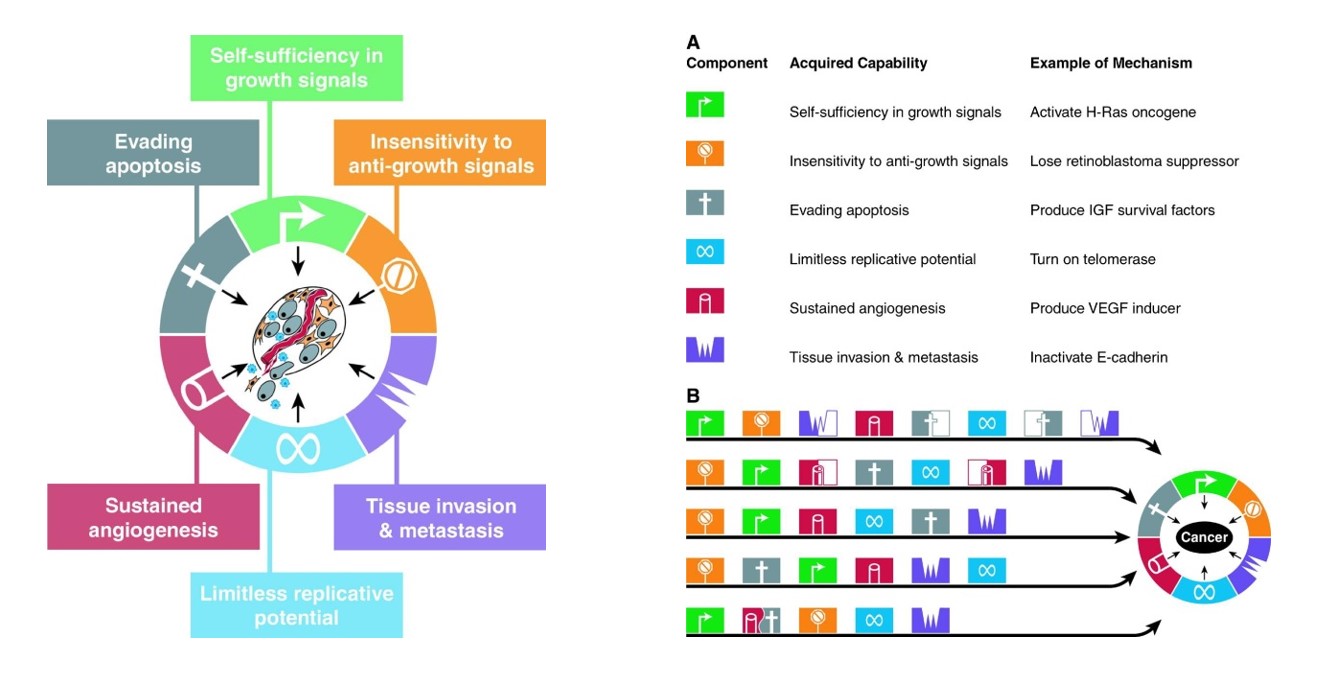
Stoga je razumijevanje svakog od temeljnih tumorskih obilježja neophodno te ću u nastavku sažeti najosnovnije ideje koje stoje iza svake od opaženih karakteristika tumora.
U normalnim stanicama dioba stanica je strogo kontrolirani događaj koji ima niz kontrolnih točaka tijekom staničnog ciklusa koje omogućavaju da se stanica dijeli samo pod točno određenim okolnostima kada je potrebno da nadomjesti neku stanicu koja se uklanja. Tako se održava homeostaza tkiva. U tumorskim stanicama je ova regulacija poremećena i dolazi do kontinuirane emisije signala za proliferaciju stanica a radi se o lučenju čimbenika rasta koji uglavnom pripadaju signalnim putevima mreže molekula Akt, MAPK/ERK i mTOR. Tumorske stanice su samodostatne u smislu aktivne proliferacijske signalizacije i ne trebaju im vanjski signali koji bi stimulirali rast i diobu jer ih same proizvode ili mutacijama trajno aktiviraju signalne puteve diobe i rasta. Negativna povratna sprega kao jedan od bitnih regulatornih mehanizama stanične signalizacije također je poremećena uslijed mutacija pa se tako proonkogeni čimbenici gomilaju u stanici jer je povratni mehanizam koji bi signalizirao da ih je previše također onesposobljen najčešće mutacijom.
Normalna stanica se nakon stimulansa na diobu dijeli sve dok ne zapuni predviđeni trodimenzionalni prostor u kojem mora zamijeniti uklonjene stanice. Kada dođe u kontakt s okolnim stanicama, aktivira se mehanizam kontaktne inhibicije kojim se signalizira da je stanica u bliskom kontaktu s okolnim stanicama te da treba zaustaviti proces diobe i rasta. Tumorske stanice postaju neosjetljive na ovaj tip blokade diobe. Također su i mehanizmi uklanjanja suvišnih i oštećenih stanica, poput apoptoze, poremećeni te se stanice nastavljaju dijeliti i rasti nakon što zapune predviđeni prostor ili steknu oštećenja koja bi ih pod normalnim okolnostima odvela u staničnu smrt i tako eliminirala iz organizma.
Tumorske stanice mogu se za razliku od normalnih stanica dijeliti gotovo beskonačno, što naravno treba shvatiti uvjetno jer i njihov rast i diobu limitira opskrba hranjivih tvari. No kod normalnih stanica broj mogućih dioba je limitiran na 60 do 70 dioba skraćivanjem telomera (rubnih dijelova kromosoma koji se pri svakoj diobi skraćuju) što ujedno predstavlja i svojevrsni „brojač“ dioba. Nakon što se telomere previše skrate, normalna stanica se više neće dijeliti. U ovom procesu je bitno da se u tumorskim stanicama održi dužina telomera jer je skraćivanje telomera također jedan od signala koji ukazuje na hiperproliferaciju maligne stanice. Tumorske stanice mogu izmanipulirati enzim koji produžuje telomere-telomerazu da ih aktivno produžava unatoč velikom broju dioba.
Tumorske stanice često imaju mutacije koje sprečavaju detekciju oštećenja unutar izmijenjenih stanica kao i sposobnost stanice da aktivira program stanične smrti pod takvim okolnostima. Stanična smrt (apoptoza) predstavlja suicidalni program koji se aktivira uslijed oštećenja genoma stanice tj. molekule DNA ali i proteina koji su vitalni za njenu funkciju. Apoptoza je program koji se okida i tijekom infekcije stanica ili embrionalnog razvoja kada se tijekom formiranja embrija neke stanice uklanjaju. Prisjetimo se faza koje prolazi ljudski embrij kada nalikuje na neke druge organizme što se zapravo smatralo rekapitulacijom evolucijskih procesa.
Kad tumorska masa postane veća od 2 mm u promjeru difuzija hranjivih tvari i kisika postaje otežana te se stoga u tumoru aktiviraju signali koji potiču nastanak nove mreže krvnih žila (neoangiogeneza) unutar tumora kako bi se tumorsko tkivo opskrbilo s dovoljno nutrijenata za tako ubrzane cikluse diobe i rasta. U ovim procesima glavnu ulogu imaju proangiogenetski čimbenici poput čimbenika rasta VEGF koji je bio i jedna od prvih uspješnih meta za razvoj pametnih lijekova koji bi se mogli primijeniti u više tipova tumora jer „gađaju“ isti proces u tumorigenezi.
Nakon inicijalne faze, progresija tumora temelji se na lokalnoj invaziji u okolno tkivo te sistemskom širenju po organizmu putem metastaza. No na tom putu također postoje prepreke kojima se organizam brani od takvih situacija. Kako bi tumorske stanice mogle prijeći u okolno tkivo i dalje u krvotok u obliku metastaza i konačno u drugo tkivo gdje će stvoriti sekundarno sijelo, moraju poprimiti čitav niz migracijskih i invazijskih sposobnosti koje nisu uobičajene za normalne zrele stanice (donekle je to karakteristika stanica tijekom embrionalnog razvoja) te biti sposobne prevladati stres puta kroz krvotok i limfotok u udaljene organe.
Nakon ovih prvih šest temeljnih obilježja tumorskih stanica, istraživanja tumora nisu stala nego su se dodatno intenzivirala čemu je uvelike pridonio i projekt Humanog genoma za koji su razvijene molekularne tehnike i instrumenti koji su danas uobičajeni inventar gotovo svakog molekularno- biološkog laboratorija. Stoga je desetljeće kasnije znanstveni časopis Cell pozvao Hanahana i Weinberga da napišu svojevrsnu dopunu prvotnog rada (do danas citiranu gotovo 70 tisuća puta). To je rezultiralo novom generacijom tumorskih obilježja kojima su uz prethodna dodana i neka nova svojstva koja su se iskristalizirala tijekom protekle dekade.2
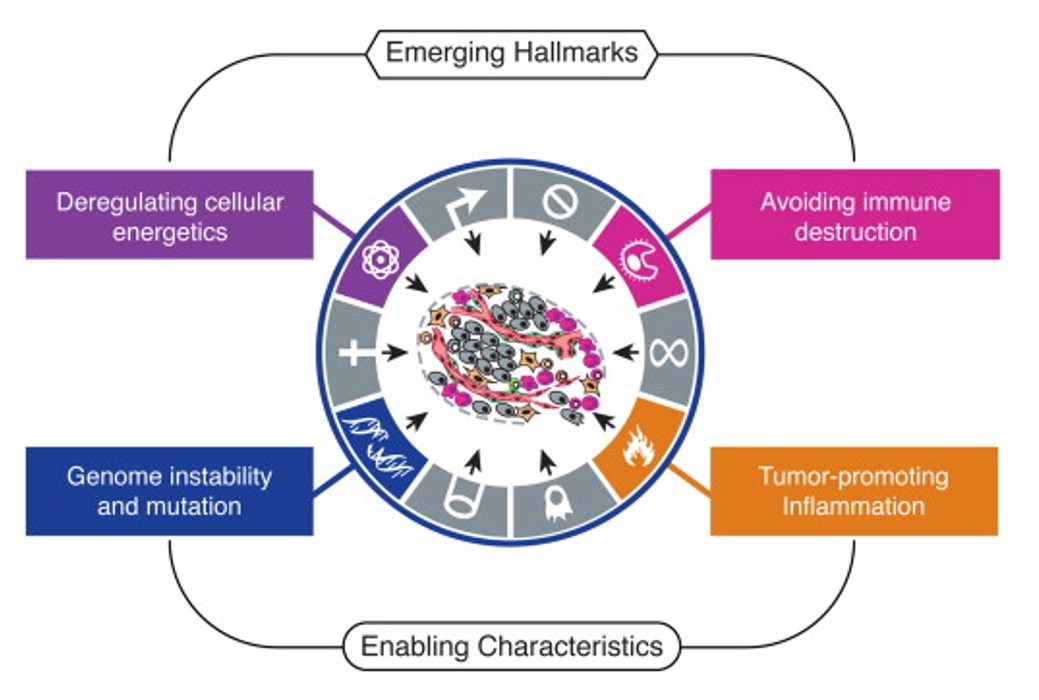
Tako su Hanahan i Weinberg u radu iz 2011. godine dodali još dvije karakteristike tumorskih stanica: izmijenjeni stanični metabolizam te izbjegavanje stanica imunosnog sustava. Tumorskim obilježjima pridodali su i dva facilitirajuća svojstva koja olakšavaju tumorskoj stanici da usvoji prethodno opisane karakteristike, kroničnu upalu te nestabilnost genoma (slika 3).
Danas znamo da tumorske stanice zbog svojeg intenzivnog rasta i diobe trebaju puno više hranjivih tvari i energije kako bi to mogle postići. Također, u središnjem dijelu tumora ukoliko opskrba hranjivim tvarima i kisikom nije adekvatna, stanice umiru uslijed nepovoljnih uvjeta. Stoga se moraju na različite načine adaptirati takvim oštrim uvjetima okoliša na način da preferencijalno koriste drugačije metaboličke puteve u odnosu na normalne stanice. Jedan od primjera je aerobna glikoliza koja se naziva još i Warburgovim učinkom prilikom kojeg se piruvat iz Krebsovog ciklusa usmjerava u proizvodnju laktata pod uvjetima prisutnosti kisika.
Dakle, umjesto da kompletno oksidiraju glukozu i dobiju što je moguće više energije u obliku molekule ATP, proces koji se odvija u mitohondrijima, stanice tumora odbiru manje energetski učinkovit metabolički put i preusmjeravaju piruvat u drugi tip razgradnje prilikom kojeg se dobivaju i građevni blokovi koji se koriste za sintezu molekula bitnih za izgradnju stanice. Ovo je samo jedan od primjera izmjena u metaboličkim putevima u tumorskoj stanici, no ovo područje je trenutno intenzivan predmet istraživanja budući da postoji mogućnost da se vanjskim utjecanjem na metaboličke puteve tumora pronađe neki locus minoris pogodan za ciljanu protutumorsku terapiju.
Svaki se dan u našem organizmu pojavljuju stanice koje imaju potencijal za malignu alteraciju, no ipak većina nas nasreću ne razvija tumor budući da naš imunosni sustav većinu uspijeva eliminirati ako sve prethodne točke provjere zakažu. No, tumorske stanice i tu vrstu obrane mogu zavarati mimikrijom ili blokiranjem signalnih molekula na stanicama imunosnog sustava i to je jedno od svojstava koje također moraju steći tijekom tumorigeneze.
Ukoliko mutacije u tumoru pogode neki od mehanizama za kontrolu točnosti i popravka zapisa u molekuli DNA tijekom njenog umnažanja, takva nefunkcionalnost postaje akcelerator svih daljnjih promjena u tumoru jer se sad mutacije koje nastaju ne popravljaju već gomilaju još bržim tempom što vodi u generalnu nestabilnost genoma i u evolucijskom smislu tumor vodi u ubrzanu spiralu napredovanja. Stoga se nefunkcionalnosti ovog tipa smatraju olakšavajućim čimbenicima u procesu tumorigeneze jer ubrzavaju evoluciju tumora.
Ukoliko su uvjeti u mikrookolišu tumora takvi da podržavaju njegovo napredovanje što znači da je mikrookoliš bogat čimbenicima rasta i diobe, kao što je to slučaj tijekom kronične upale, i ovo svojstvo se smatra facilitirajućim za proces tumorigeneze. Primjeri takvih dugotrajnih upalnih procesa koji na kraju rezultiraju tumorom su najprije opisani vezano uz tumore probavnog sustava, no ova se komponenta danas pronalazi u gotovo svim tipovima tumora kao pojava koja prethodi te olakšava proces tumorigeneze.
Nakon dva desetljeća od prvotnog rada Hanahan je prošle godine napisao još jedan pregledni rad u kojem je obuhvatio potencijalne nove dimenzije u razumijevanju tumorigeneze.3 U ovom radu osvrnuo se na fenomen fenotipske plastičnosti tumorskih stanica, njihovo epigenetsko reprogramiranje te utjecaj mikrobioma samog tumorskog okoliša. Ovo su područja koja se uistinu sve više istražuju kao bitne determinante nastanka i napredovanja tumora (slika 4)
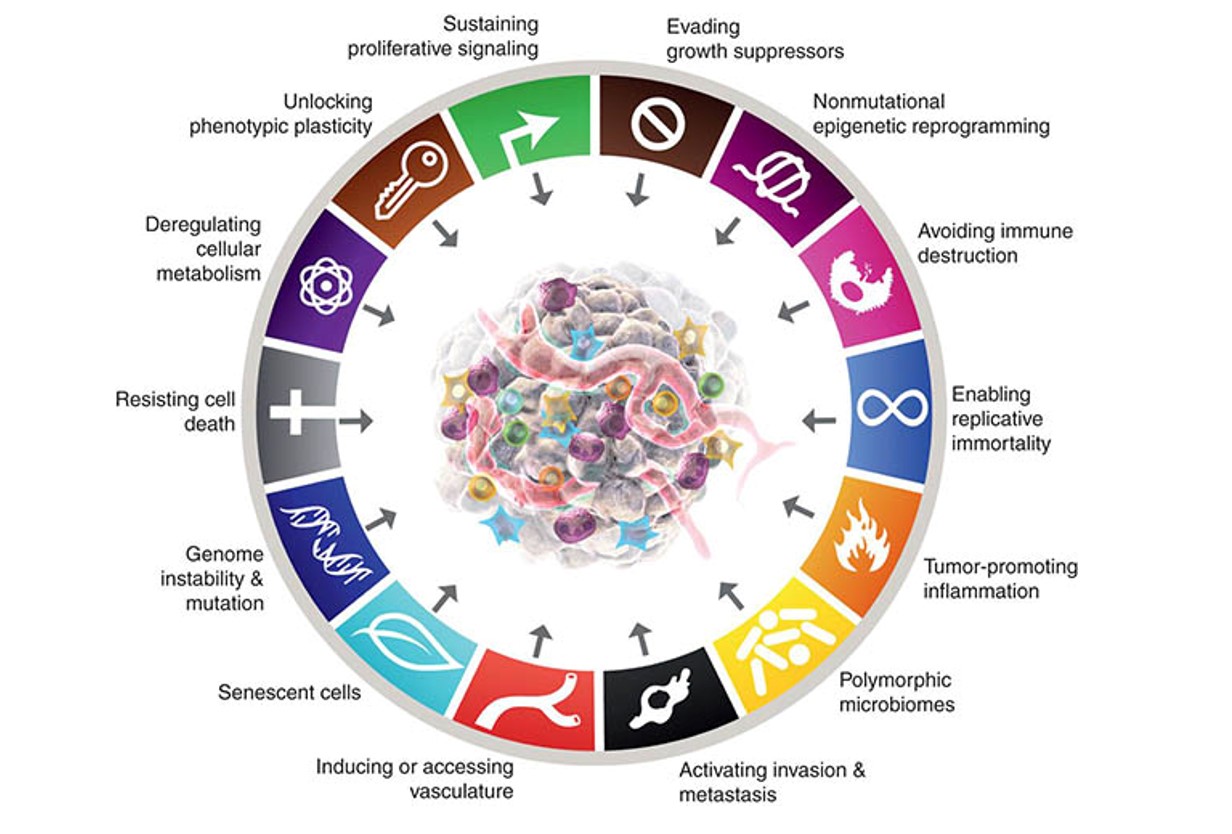
Pod plastičnosti fenotipa podrazumijeva se svojevrsna lakoća prelaženja tumorskih stanica iz više u manje diferencirana stanja te diferenciranje u sasvim drugim smjerovima od onih koji su bili prvotno namijenjeni dok je stanica bila normalna. Pojam diferenciranosti je pojam koji u normalnim stanicama označava njihovu konačnu specijalizaciju za neku funkciju. Kada se pogleda građa nekog tkiva već je na prvi pogled, morfološki, jasno da možemo razlikovati nekoliko tipova stanica koje su prilagođene za svoju funkciju. Često kažemo i terminalna diferencijacija čime se potencira činjenica da se normalna stanica koja se jednom diferencirala za neku funkciju ne može vratiti natrag u omni/pluripotentno stanje. Zbog toga u svakom tkivu i postoje tzv. matične stanice koje imaju takva svojstva i služe da se od njih diferenciraju stanice koje je u nekom tkivu potrebno zamijeniti.
Jedno od glavnih obilježja tumora jest nediferenciranost stanica. Ponekad su histološki preparati tumora toliko izmijenjeni da je teško razaznati o kojim se tipu stanica uopće radi. Do toga je došlo jer su se stanice tumora dediferencirale natrag u nešto što nalikuje stanicama od kojih su nastale ili zbog toga što su se tumorske stanice nakon diobe zaustavile u nediferenciranom stanju koje nikad neće krenuti u daljnju diferencijaciju. Također je moguće da se stanice transdiferenciriraju odnosno pređu iz jedne vrste specijalizacije u drugu. Ovaj fenomen je bitan za nastanak i napredovanje tumora ali također i za odgovor na terapiju jer zahvaljujući plastičnosti tumorskih stanica one mogu izbjeći njenu toksičnost.
Epigenetsko reprogramiranje tumorskih stanica odnosi se na promjene koje utječu na ekspresiju gena i mijenjaju je no ne radi se o mutacijama na razini zapisa u molekuli DNA već na razini njegove egzekucije. Do ovakvog reprogramiranja tumorskih stanica može doći pod utjecajem oštrih uvjeta u okolišu ili kad tumorske stanice moraju razviti dodatna svojstva kako bi se proširile u okolinu i metastazirale.
Danas znamo da je naše tijelo stanište mnogobrojnih mikroorganizama koje nazivamo našim mikrobiomom. Načelno se smatra da su populacije pojedinih mikroorganizama u ravnotežnim odnosima koji ne narušuju naše zdravlje. No sve je više indicija da neke bakterije koje su se smatrale relativno benignim stanovnicima jer ne izazivaju akutna stanja u našem organizmu ipak mogu pridonijeti nastanku tumora. Jedan od takvih primjera je Helicobacter pylori koji je danas povezan s nastankom tumora želuca. No takvih mikroorganizama ima po cijelom probavnom sustavu te iako ih je teško izolirano pratiti postoje indicije da putem izazivanja kroničnih upalnih stanja zapravo pogoduju nastanku tumora te se zbog toga smatraju facilitirajućim čimbenicima tumorigeneze.
Normalne stanice koje su odradile svoj radni vijek ili su oštećene zastaju s diobama te ih ukoliko ostanu u tkivu nazivamo senescentnim stanicama. Možemo reći da se radi o umirovljenim stanicama te se prvotno smatralo kako je njihova uloga nevažna, no danas znamo da one poprimaju specifični izgled te su i dalje aktivne u smislu izlučivanja nekih čimbenika. Takav fenotip stoga nazivamo sekrecijskim fenotipom koji je povezan sa senescencijom (SASP, od engl. senescence-associated secretory phenotype). Budući da se pri tome luče i čimbenici koji mogu imati i protu i pro upalni i tumorski, učinak ovisno o kontekstu ostale stanične signalizacije, postojanje ovakvih stanica u tkivu nije bezazleno.
Zašto su uopće važni ovi pokušaji pronalaženja zajedničkih tumorskih obilježja? Kada se nastanak i napredovanje tumora fragmentira na ključne prekretnice u preobrazbi normalnih stanica u maligne onda postaju vidljivije i mete na koje bi se moglo djelovati u smislu ciljane protutumorske terapije. Ponekad se dogodi da su u pojedina od ovih svojstava uključeni isti geni no većinom su oni specifični za pojedini tip tumora. Prepoznati da gen X u jednom tipu tumora omogućava invazivnost i metastaziranje, može pomoći da se otkrije ima li takvu ulogu i u nekom drugom tipu tumora ili da se pronađe njegov pandan na temelju ideje da svi tumori imaju neka zajednička obilježja.
Na ovaj se način mogu identificirati i mete koje potencijalno imaju ulogu u tumorigenezi više različitih tipova tumora. Takav pristup je uostalom iznjedrio i prve „univerzalne“ ciljane terapije poput primjerice protutijela na čimbenik VEGF koji je ključan akter u angiogenezi pa se lijekovi tog tipa danas primjenjuju u različitim tipovima tumora. Posljednji takav uspjeh su tzv. checkpoint inhibitori, protutijela na protein PD-1 koji se nalazi na površini T i B limfocita i bitan je za njihovu funkciju u imunosnom odgovoru na tumor. Pokazalo se da tumori u kojima je prisutna genomska nestabilnost na razini malih repetitivnih sekvenci dobro reagiraju na terapiju ovim protutijelom te je to postala glavna indikacija za administriranje ove terapije za uznapredovale solidne tumore različitog tipa. Iako smo još daleko od bilo kakve smislene manipulacije mikrobiomom, ideja da bi se na taj način moglo utjecati na okoliš stanice koja je maligno alterirala ima također smisla. Pronalaženje zajedničkih temeljnih principa većine tumora te razvoj terapija koje ciljaju te principe možda bi nas stoga ipak barem malo moglo približiti idealu pronalaženja „lijeka za rak“ kako se to kolokvijalno kaže.
1) Hanahan D, Weinberg RA. The hallmarks of cancer. Cell. 2000;100(1):57-70. doi: 10.1016/s0092-8674(00)81683-9.
2) Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646-74. doi: 10.1016/j.cell.2011.02.013.
3) Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022 12(1):31-46. doi: 10.1158/2159-8290.CD-21-1059.