MOLEKULARNA BIOLOGIJA
Vladaju li nama bakterije? Novi pogled na evoluciju organizama
 Tamara Čačev / 20. veljače 2025. / Perspektive / čita se 13 minuta
Tamara Čačev / 20. veljače 2025. / Perspektive / čita se 13 minuta

 Tamara Čačev / 20. veljače 2025. / Perspektive / čita se 13 minuta
Tamara Čačev / 20. veljače 2025. / Perspektive / čita se 13 minuta

Prirodna selekcija ne usmjerava samo čovjekov genom, već i gene mikroorganizama koji ga nastanjuju, piše Tamara Čačev u tekstu o sintezi znanstvenog pogleda na odnos organizama i njihovih mikrobioma. Bakterije prisutne u ljudima obavljaju cijeli niz važnih životnih funkcija - „treniraju“ naš imunološki sustav, sintetiziraju esencijalne hranjive tvari i sudjeluju u nastanku ili sprečavanju upalnih, neuroloških i metaboličkih poremećaja. Razumijevanje njihove uloge u cjelovitom holobiontu otvara put prema eri u kojoj bi se mikroorganizmima moglo manipulirati na našu korist.
Na jednom davnom predavanju čula sam jednu zanimljivu informaciju o tome kako zajedno s nama kroz život putuje i nekoliko kilograma bakterija. Znam da sam se tada upitala kako to da onda ne smršavimo nakon primjene antibiotika. Naravno, to ne ide baš tako jer niti je moguće ubiti sve bakterije u nekom organizmu, niti bi to bilo pametno. Neki se možda zgražaju na ideju da po nama i u nama „gmižu“ nekakvi mikroorganizmi, no činjenica je da su oni mnogo više od potencijalne ugroze kako ih većina percipira. Zapravo od njih imamo jako puno koristi te se danas smatra kako čovjek i njegovi mikroorganizmi predstavljaju holobiont s međusobno nadopunjujućim hologenomom.
Definicija holobionta jest da se radi o organizmu udruženom sa svim njegovim mikroorganizmima (bakterijama, virusima, gljivama i arhejama) koji se promatraju kao jedinstvena biološka jedinika. U osnovi takvog pogleda nalazi se činjenica da je domaćin (čovjek ili neki drugi organizam) neodvojivo povezan sa svojim mikrobiomom koji utječe na njegov razvoj, fiziologiju pa čak i evoluciju. Pod pojmom hologenom pak podrazumijevamo skup svih gena tj. ukupnu genetičku informaciju koja je zapisana u nukleinskim kiselinama domaćina i njegovih mikroorganizmama. Smatra se kako u našim crijevima živi 2000 različitih vrsta bakterija te da ukupni genom mikroorganizama u crijevu 150 puta nadmašuje broj gena u genomu čovjeka. Spektar mikroorganizama koji nastanjuje naš organizam razvija se nakon našeg rođenja (smatra se da čak i tip poroda na to utječe) te najprije doprinosi razvoju našeg imunološkog sustava. Zatim, naseljavanje mikroorganizama u probavni sustav djeteta omogućava da se proizvode za nas esencijalne aminokiseline i vitamini.
Naš se mikrobiom postupno razvija kroz djetinjstvo te postiže svoj ravnotežni sastav u dobi od 3-6 godina i ostaje u toj dinamičkoj ravnoteži stabilan kroz cijelu našu odraslu dob. U odrasloj dobi mikroorganizmi sudjeluju u ekstrakciji hranjivih tvari iz hrane, reguliraju naš imunološki odgovor ali i autoimune reakcije. Zaduženi su također za održavanje barijere crijeva što je esencijalno da neželjeni mikroorganizmi i tvari ne uđu u naš organizam. Danas se sve više saznaje i o metaboličkoj ulozi mikroorganizama primjerice u metabolizmu kolesterola ili žučnih kiselina, no oni mogu utjecati i na to kako metaboliziramo lijekove te hoće li oni u našem organizmu stići na pravo mjesto u pravoj dozi.
I tako dolazimo do pomaka u paradigmi promatranja evolucije organizama gdje se danas smatra kako prirodna selekcija kao evolucijska sila ne djeluje samo na domaćina izdvojenog od svog mikrobioma, već da djeluje i usmjeruje evoluciju svih genoma koji čine holobionta. Ovakvim pomakom u pogledu moguće je bolje sagledati fenomene poput razvoja imunološkog sustava te neke metaboličke procese koji se ne događaju izolirano u vakuumu već kao rezultat međuigre spojeva koje koriste i prepoznaju i domaćin i njegovi mikroorganizmi. Primjerice bakterije „treniraju“ naš imunološki sustav i sudjeluju u sazrijevanju i regulaciji imunoloških odgovora kroz interakcije s crijevnim limfoidnim tkivom.
Spojevi koje crijevne bakterije proizvode, poput lipopolisaharida (LPS) ili peptidoglikana, moduliraju aktivnost dendritičkih stanica, limfocita i makrofaga. Zanimljivo je da su bakterije iz rodova Bifidobacterium i Lactobacillus poznate po svojoj sposobnosti da smanje upalne procese i potaknu proizvodnju regulatornih T-stanica (Treg), čime se prevenira razvoj autoimunih bolesti. Simbiotske bakterije, poput onih iz rodova Bacteroides i Firmicutes, razgrađuju složene ugljikohidrate koje ljudski enzimi ne mogu probaviti, proizvodeći kratkolančane masne kiseline ((engl. short-chain fatty acids, SCFA) poput butirata, propionata i acetata. Butirat, primjerice, služi kao primarni izvor energije za enterocite, potiče intestinalnu barijeru i ima protuupalne učinke. Mikrobiom crijeva bitan je i u sintezi vitamina B12 i vitamina K.
Također, pokazalo se da ukoliko se ta fina ravnoteža međuodnosa poremeti, nastaje disbioza, stanje u kojem dolazi do disbalansa unutar pojedinih zajednica mikroorganizama što može imati štetne posljedice za samog domaćina. Ta se šteta manifestira u razvoju upalnih bolesti crijeva ali i debljine i metaboličkih bolesti te neuropsihijatrijskih stanja.
Vjerojatno je mnogima poznata anglosaksonska sintagma „crazy cat lady“ koja je doživjela svoju reinterpretaciju na nedavnim američkim predsjedničkim izborima. Za one koji se nisu s time susreli, radi se o stereotipnoj ženskoj osobi koja s vremenom oko sebe sakuplja gomilu mačaka i uz koju se onda veže i gomila drugih stereotipnih epiteta i karakteristika. Možda je to zato što su žene empatičnije i sklonije se sažaliti nad nemoćnim životinjicama na ulici, no nije bez vraga da se radi baš o mačkama. Mačke su naime primarni domaćini praživotinji Toxoplasma gondii. No, sve toplokrvne životinje, uključujući i ljude mogu biti njeni prolazni domaćini. Zanimljivo je da kod glodavaca infekcija Toxoplasmom smanjuje strah od mačaka, te tako oni postaju laki plijen. Smatra se kako su glodavci zapravo izmanipulirani ovom praživotinjom kako bi završili kao hrana mački koja je njezin ultimativni cilj kao poželjni domaćin u kojem dolazi do njenog razmnožavanja. Ubrzo se počelo spekulirati kako bi Toxoplasma mogla utjecati i na ponašanje inficiranih ljudi te modificirati njihovu osobnost. No, unatoč ekstenzivnoj eksploataciji stereotipne crazy cat lady u popularnoj kulturi zasad nije utvrđena direktna uzročno-posljedična veza između Toxoplasme i ovakvog životnog stila.
Ipak ta ideja da nas mikroorganizmi koji žive s nama u zajednici mogu izmanipulirati ima sve više utemeljenja kada su u pitanju naše bakterije. Već su opisani primjeri patogenih bakterija ali i onih simbiotskih koje su razvile vrlo sofisticirane strategije kako da ovladaju ponašanjem domaćina (najčešći su primjeri kukaca i glodavaca) i usmjere ga ka onim situacijama koje olakšavaju njihov prijenos, preživljavanje ili kolonizaciju. U te interakcije uključeni su molekularni mehanizmi kojima se bakterije putem svojih signalnih molekula infiltriraju u signalizacijske mreže domaćina i to osobito one koje reguliraju živčani, endokrini i imunološki sustav.
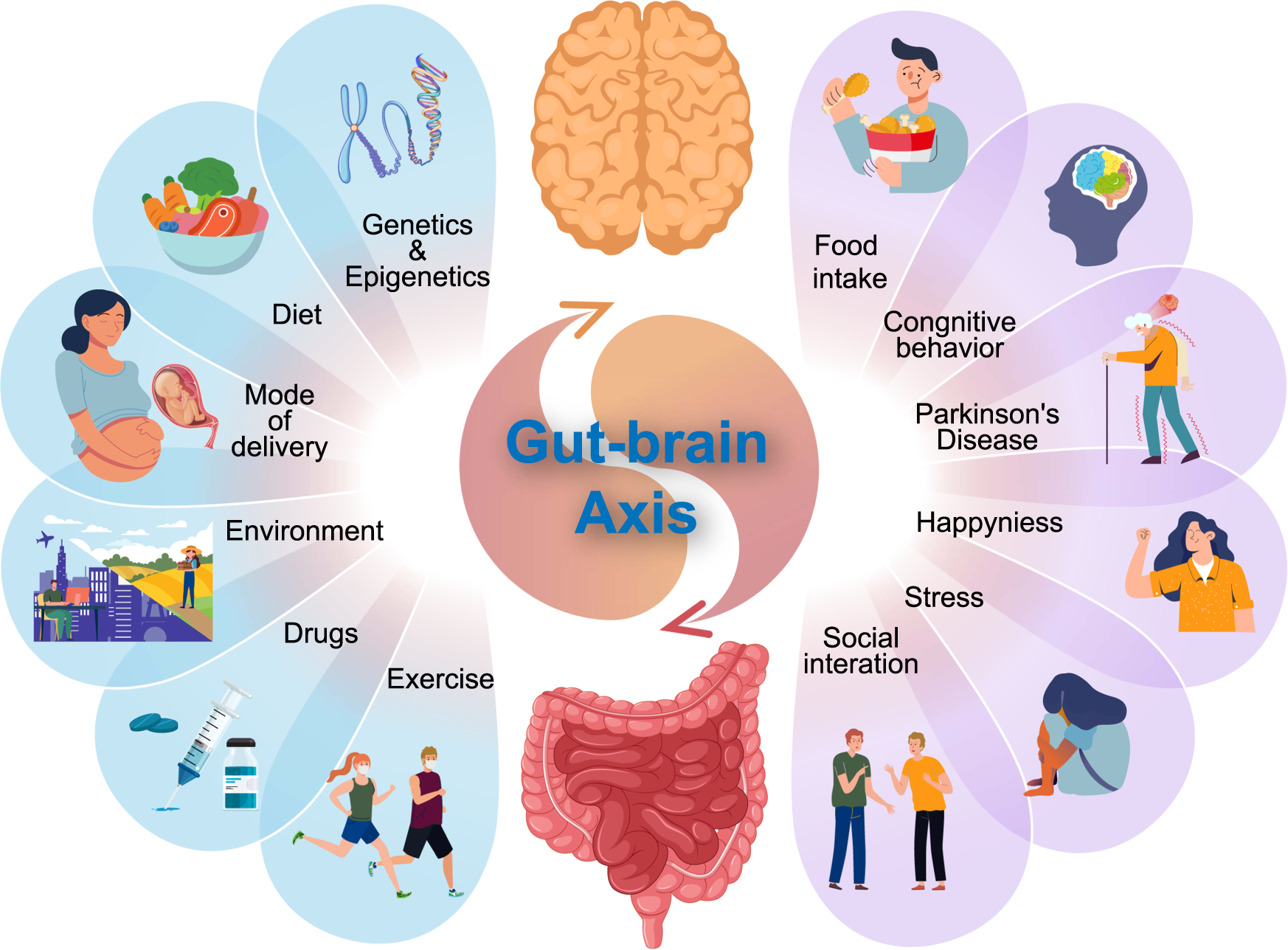
U fiziologiji se mnogi procesi u organizmu povezuju u sklopove tzv. osovine (sigurno ste čuli npr. za osovinu hipotalamus-hipofiza). Ideja iza toga je da udaljeni dijelovi tijela ili neki organi ciljano međusobno komuniciraju razmjenjujući signalne molekule. Stoga se i naš mikrobiom počelo promatrati kroz prizmu potencijalnih osovina putem kojih utječe na neke od ciljnih organa u našem organizmu. Komunikacija između crijeva i mozga odvija se dvosmjerno između mikrobioma crijeva te središnjeg živčanog sustava i tu osovinu stoga nazivamo još i mikrobiom-crijevo-mozak osovinom. U ovoj komunikaciji sudjeluje naš imunološki sustav, živac vagus, živčani sustav oko našeg probavila, neuroendokrini organi te krvotok. Crijevna mikrobiota može pomoći u modulaciji homeostaze i ponašanja svog životinjskog domaćina kroz kemijsku komunikaciju sa živčanim sustavom, uključujući i “izravnu” i “neizravnu” signalizaciju. Kao primjer izravne signalizacije, kratkolančane masne kiseline (SCFA), lipidi koje proizvode crijevni mikroorganizmi fermentacijom dijetnih vlakana mogu djelovati na središnji živčani sustav (CNS) regulirajući neuroplastičnost, epigenetsku regulaciju i ekspresiju gena te imunološki sustav u pretkliničkim modelima. S druge pak strane bakterije mogu primati signale odaslane putem neurotransmitera uključujući serotonin, dopamin i GABA te se tako može ostvariti svojevrsna komunikacija između mozga domaćina i crijevnog mikrobioma.
Mikrobiom crijeva sintetizira neurološki aktivne spojeve koji mogu utjecati na rad mozga na način da reguliraju proizvodnju i prijenos neurotransmitera koji se u njemu sintetiziraju. Primjerice, danas se zna da bakterije u crijevu metaboliziraju aminokiselinu triptofan u serotonin i druge metabolite te tako utječu na njegovu razinu u mozgu.
Također je pokazano kako anksiozne osobe imaju povišene razine proupalnih citokina te smanjene razine mikroorganizama koji proizvode SCFA i djeluju protuupalno. Mikroorganizmi u crijevima mogu metabolizirati triptofan i u indol koji pak utječe na sekreciju hormona GLP-1 koji u crijevima regulira razinu glukoze i inzulina kao dio odgovora na unesenu hranu. GLP-1 stimulira proizvodnju inzulina te smanjuje produkciju glukoze u jetri. Pokazalo se također da ukoliko prehranom unosimo dovoljno vlakana, mikroorganizmi u našem crijevu sintetiziraju SCFA koje također potiču izlučivanje GLP-1. Povišene razine GLP-1 doprinose poboljšanju inzulinske osjetljivosti, usporavanju pražnjenja želuca i reguliraju apetit i to je indirektni način kako mikroorganizmi mogu utjecati na svog domaćina. Takav učinak imaju i danas popularni lijekovi za dijabetes koji se danas koriste i kao terapija za mršavljenje Ozempic, Munjaro, Wegovy i slično.
Ako iz nekog razloga dođe do poremećaja dinamičke ravnoteže između mikroorganizama u našim crijevima, kao što to može biti slučaj zbog primjene antibiotika ili promjene stila prehrane (post, vegetarijanstvo, veganstvo), tada dolazi do poremećaja u uobičajenom sastavu i brojnosti tih populacija i stanja tzv. disbioze. Poremećaj u omjeru i sastavu mikroorganizama vodi do poremećaja u sastavu i količinama metabolita i signalnih molekula koje ti mikroorganizmi proizvode. Produženo stanje disbioze zatim može dovesti do povećane zastupljenosti bakterija koje sintetiziraju spoj LPS i nastanka bolesti kao što su upalne bolesti crijeva (ulcerozni kolitis ili Chronova bolest). Naime, LPS utječe na integritet crijevne barijere te također okida imunološki odgovor organizma što oboje u konačnici dovodi do oštećenja i propusnosti ove barijere. Na taj način mikroorganizmi iz crijeva te LPS prelaze u krvotok i dalje u organizam. Povišene razine LPS-a u krvotoku do danas su povezane s kroničnom upalom, inzulinskom rezistencijom, debljinom, dijabetesom tipa 2 te tumorskim bolestima kao i poremećajima raspoloženja (anksioznost, depresija), neuropsihijatrijskim poremećajima (autizam, shizofrenija) te neurodegenerativnim bolestima (Parkinson i Alzheimer). U disbiozi može doći i do smanjenih razina kratkolančanih masnih kiselina (SCFA) koje su dovedene u vezu s autizmom i epilepsijom.
Disbioza je uvrštena i među ključne pokazatelje starenja (hallmarks of aging). Ipak, valja reći kako su većina ovih studija korelacijske naravi te je teško utvrditi uzročno-posljedičnu povezanost između promjena u crijevnoj mikrobioti i bolesti, s obzirom na to da nije jasno jesu li te promjene uzrok, posljedica ili samo popratna pojava bolesti. Stoga treba biti pažljiv u interpretaciji dobivenih rezultata jer kao što znamo korelacija nije uvijek kauzacija. Korelacije između sastava crijevne mikrobiote, homeostaze mozga i patofiziologije različitih neuroloških poremećaja su utvrđene; međutim, primjeri mehanističkih objašnjenja koji podupiru te veze još uvijek su ograničeni dijelom zbog činjenice da interakcije između crijevne mikrobiote i mozga često uključuju više načina komunikacije (imunološki, endokrini, neuronski i dr.) te mogu uključivati i spojeve koje proizvode različite bakterije. Primjerice, način na koje mikroorganizmi mogu pridonijeti Parkinsonovoj bolesti jest tako da utječu na proces stvaranja trodimenzionalne strukture proteina koja je bitna za njegovu funkciju. Pri tome u Parkinsonovoj bolesti može doći do „sljepljivanja“ fosforiliranog α-sinukleina (αSyn) kako u crijevima, tako i u mozgu, što je jedan od bitnih elemenata za propadanje neurona u ovoj bolesti. Mikroorganizmi mogu utjecati i na učinkovitost terapije za ovu bolest jer neke crijevne bakterije mogu razgraditi levodopu (terapijska supstanca) prije nego što ona uspije doći do mozga gdje bi trebala djelovati.
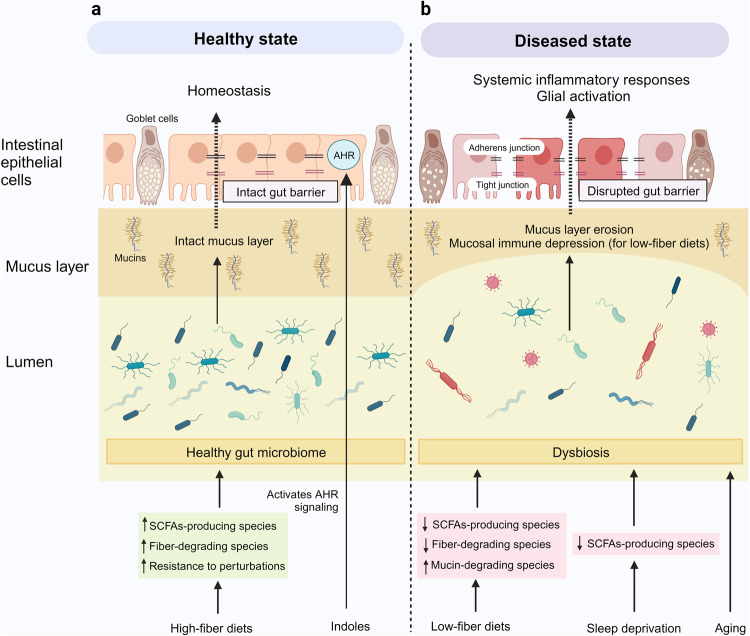
Možemo li utjecati na naše zdravlje kroz utjecaj na naš mikrobiom? Danas su popularne suplementacije probioticima i prebioticima koje su u određenim situacijama opravdane, no mnogi ih konzumiraju a da i ne znaju sami zbog čega. Iako se može činiti bezazlenim, uzimanje probiotika svakako će kratkotrajno (dok se uzimaju) utjecati na ravnotežu mikroorganizama u našim crijevima. No, pokazalo se da čim se vratimo na staru prehranu, uspostavlja se ravnoteža mikroorganizama koje smo imali prije. Također, to umjetno dodavanje velike količine mikroorganizama, kao i prebiotika, tvari koje mikroorganizmi konzumiraju, izvana u naš probavni sustav može također izazvati disbiozu i i imati negativne učinke na naš organizam. Ipak, već od davnina ljudi su konzumirali fermentirane mliječne napitke poput kefira za koje znamo da imaju blagotvorne učinke na naš organizam. Kefirna zrnaca sadrže složenu zajednicu bakterija mliječne kiseline (npr. Lactobacillus, Lactococcus, Leuconostoc) i kvasaca.
Ova kompleksna zajednica doprinosi stvaranju širokog spektra bioaktivnih spojeva tijekom fermentacije. Kefir izaziva proizvodnju kratkolančanih masnih kiselina (SCFA) poput butirata, propionata i acetata. Butirat je glavni izvor energije za crijevne epitelne stanice te doprinosi održavanju integriteta crijevne barijere. Bioaktivni peptidi i druge fermentacijske tvari prisutne u kefiru mogu također modulirati imunološki odgovor. Interakcijom s crijevnim limfoidnim tkivom potiču sazrijevanje imunoloških stanica te smanjuju upalne procese, što je ključno za prevenciju kroničnih upalnih stanja. Kefir može inhibirati rast patogenih mikroorganizama u crijevima putem konkurentske isključenosti i proizvodnje antimikrobnih spojeva, čime doprinosi održavanju zdrave ravnoteže mikrobioma. Drugi bakterijski pripravak koji se danas nalazi prisutan u našoj prehrani je Lactobacillus rhamnosus GG (LGG). LGG je jedan od najviše proučavanih sojeva probiotika zahvaljujući svojoj sposobnosti da preživi želučanu kiselinu te se uspješno kolonizira u crijevni trakt. Tamo potiče sintezu sluzi i jača interakcije između epitelnih stanica, čime se povećava cjelovitost crijevne barijere. Time se smanjuje propusnost crijeva, što je ključno u prevenciji “curenja” patogenih tvari u sistemsku cirkulaciju. LGG utječe na imunološki sustav stimulirajući proizvodnju regulatornih T-stanica (Treg) i potiskujući prekomjerne upalne odgovore. Time se postiže uravnoteženost imunološkog odgovora, što može biti korisno u prevenciji i liječenju autoimunih bolesti i alergijskih stanja.
Kada u cijelosti spoznamo dinamiku zajednica mikroorganizama koji u nama žive, u što sve više vjerujem budući da je tehnologija u eksperimentalnom dijelu prikupljanja podataka kao i u onom analitičkom napravila ogromne iskorake, ući ćemo u eru u kojoj ćemo mi manipulirati mikroorganizmima u našu korist. Iako se čini kao znanstvena fantastika, moguće je da ćemo rješenja za neke nama danas nerješive bolesti pronaći upravo u dirigiranom orkestriranju sinteze nama korisnih spojeva koje proizvode naši sustanari.
1) Loh JS, Mak WQ, Tan LKS, Ng CX, Chan HH, Yeow SH, Foo JB, Ong YS, How CW, Khaw KY. Microbiota-gut-brain axis and its therapeutic applications in neurodegenerative diseases. Signal Transduct Target Ther. 2024;9(1):37.
2) Morais LH, Schreiber HL 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. Nat Rev Microbiol. 2021;19(4):241-255.