nobelova nagrada za medicinu
Tumorska stanica vara imunološki sustav. Ovogodišnji nobelovci smislili su kako prevariti prevaranta
 Tamara Čačev / 4. listopada 2018. / Aktualno / čita se 11 minuta
Tamara Čačev / 4. listopada 2018. / Aktualno / čita se 11 minuta

 Tamara Čačev / 4. listopada 2018. / Aktualno / čita se 11 minuta
Tamara Čačev / 4. listopada 2018. / Aktualno / čita se 11 minuta

Na temelju istraživanja ovogodišnjih laureata razvijena je sasvim nova klasa antitumorskih lijekova koji su se pokazali uspješnima u terapiji tumora pluća, bubrega, limfoma i melanoma. Nažalost kako se radi o izrazito snažnim mehanizmima imunološkog sustava reakcija koju oni izazivaju u organizmu odgovorna je i za jake i ozbiljne nuspojave ovih terapija. Ipak, širenje spektra protutumorskih lijekova, ohrabruje naša nastojanja da jednoga dana tumorske bolesti postanu kronične bolesti s kojima će ljudi moći živjeti kao i svi drugi kronični bolesnici
Ovogodišnja Nobelova nagrada za fiziologiju ili medicinu dodijeljena je dvojici znanstvenika, prof.dr. Jamesu Allisonu iz MD Anderson Cancer Centra, vodećeg kliničko-istraživačkog centra za tumorske bolesti u SAD te prof. dr. Tasuku Honjou sa Sveučilišta Kyoto iz Japana. Ova dvojica znanstvenika su neovisno radeći na imunologiji tumora istražili bitne molekularne mehanizme pomoću kojih imunološki sustav prepoznaje stanice tumora i nastoji ih ukloniti te kako se ti mehanizmi aktiviraju i utišavaju. Rad ovih znanstvenika iz devedesetih godina 20. stoljeća je relativno brzo našao i svoju konkretnu primjenu u stvaranju novih tipova antitumorskih terapija. Posebno je značajan iskorak temeljen na ideji ovih dvaju znanstvenika napravljen u terapiji melanoma u proteklih desetak godina, to prije što je do pojave novih lijekova ovoga tipa, kao i nekih lijekova ciljanih na specifične molekualarne promjene u genima, terapija melanoma imala oskudan broj opcija.
No, prije nego se osvrnem na konkretne molekularne mehanizme kojima su se bavili ovi znanstvenici reći ću nešto o tome kako tumori nastaju. Kako je vidljivo već iz samog imena, tumorske bolesti nisu jedinstveni entitet. Na razini kliničke manifestacije je jasno da tumori pogađaju različita tkiva i organe s različitim tipovima i tijekom bolesti. Na molekularnoj razini same tumorske stanice danas se zna da promjene koje stoje u podlozi nastanka i napredovanja tumora imaju različiti tijek ovisno o tipu tumora. Općenito se može reći kako je nastanak tumora stupnjeviti proces tijekom kojeg neka normalna stanica postupno skuplja mutacije (koje su dijelom inducirane i našim vlastitim djelovanjem, primjerice pušenjem, životnim stilom, čimbenicima okoliša) u onkogenima i tumor supresorskim genima koje se ne uspiju popraviti/ukloniti mehanizmima popravka stanične DNA ili imunološkim mehanizmima. Područje istraživanja genetike tumora jedno je od najpropulzivnijih u svijetu i svake se godine generira ogromna količina novih informacija čime se gradi složena slika molekularnih promjena koje su potrebne da se normalna stanica započne nekontrolirano dijeliti i stvarati tumor.
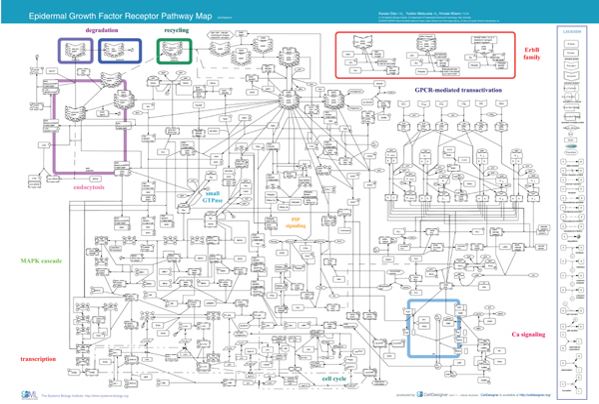
U svakoj našoj stanici svake milisekunde međusobno komuniciraju milijuni molekula i prenose signal o tome što ta stanica mora raditi i kako se mora ponašati u okolini drugih stanica. Možemo si to možda može najbolje predočiti tako da zamislimo stanicu kao plan metroa u Tokyu i ljude i vlakove koji kroz njega u svakom trenu prolaze pri čemu sve funkcionira u savršenom redu (Slika 1). Naravno, ta slika je samo gruba ideja onoga što se u stvarnosti događa svakog trenutka u svakoj našoj stanici. Kao ilustraciju pogledajte sliku 2 koja je nepotpuni prikaz interakcija samo jednog signalnog puta, puta EGFR receptora inače bitnog za čitav niz ključnih procesa u stanici.
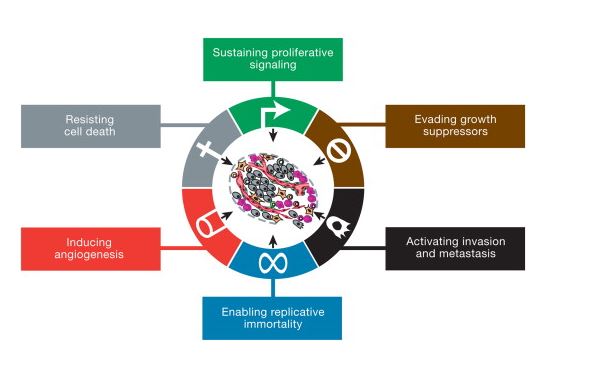
Dakako, kad uvidimo koliko se kompleksni događaji odvijaju svakog trenutka u svakoj stanici teško je pojmiti kako je moguće da sve tako savršeno funkcionira većinu vremena. Nažalost, ponekad se ovi sustavi poremete i tada se javlja bolest. U vodećem znanstvenom časopisu Cell izašao je 2000. godine paradigmatski rad dvojice autora dr. Hanahana i dr. Weinberga u kojem se pokušalo desetljeća otkrića različitih molekularnih promjena u tumorima usustaviti u neke općenite principe koji će dati odgovor na to kako neka stanica postaje tumorska i kako se širi prvo u okolno tkivo a zatim i dalje kroz organizam te stvara metastaze.1 Ukratko, kako bi se neka normalna stanica transformirala u tumorsku mora doći do poremećaja u funkciji/signalima u šest najbitnijih staničnih procesa koje su autori nazvali ključnim karakteristikama („hallmarks of cancer“):
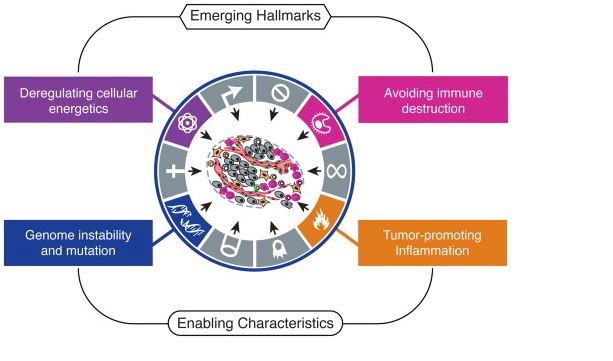
Ovaj rad postao je najcitiraniji rad u povijesti časopisa Cell a 2011. godine je izašla i njegova dopuna u kojoj su ovim prvotnim svojstvima dodana još dva te „pospješujuće“ karakteristike (slika 4).2 Pod tim pospješujućim karakteristikama podrazumijevaju se generalni poremećaji sustava stanice koji na globalnoj razini rade oštećenja DNA a to su nestabilnost genoma te upalni procesi. Nova dodana svojstva bila su
Tako konačno dolazimo do toga zašto je područje kojim se bave ovogodišnji Nobelovi laureati od ogromne važnosti budući da je gotovo za sve prije navedene procese dodijeljena Nobelova nagrada, barem za neki od njihovih segmenata.
Sad kada ste dobili općeniti kontekst nastanka i napredovanja tumora vratimo se na to što su ovogodišnji dobitnici Nobelove nagrade otkrili. Iz prije navedenog jasno je da je naš imunološki sustav jedna od ključnih karika koja neprestano kontrolira situaciju u našem tijelu i uklanja stanice koje nas ugrožavaju, bili to mikroorganizmi ili naše vlastite oštećene ili maligno alterirane stanice. Taj mehanizam kontrole je strašan, nevjerojatno efikasan i svakodnevno godinama uklanja takve stanice, no nažalost nije savršen. Ponekad (u kontekstu koliko je to događaja, zapravo vrlo rijetko) pogriješi i tada propusti tumorsku stanicu kroz svoju kontrolu. Naravno, i tumorske stanice su razvile mehanizme kako prevariti imunološki sustav te mu se prikazati kao normalne čime se neće upaliti alarm za njihovu eliminaciju. Stanice imunološkog sustava pri kontaktu s nekom neidentificiranom stanicom traže određene „oznake“ po kojima će utvrditi da li se radi o normalnoj stanici koju treba ostaviti na miru ili o malignoj stanici koju treba uništiti. Kako takva identifikacija prethodi vrlo snažnim i uništavajućim mehanizmima eliminacije jasno je da i mehanizmi prepoznavanja imaju u sebi ugrađene tzv. check-pointe koji služe kao osiguranje da imunološki sustav ne bi počeo nekontrolirano napadati naše stanice kako se to događa npr. u autoimunim bolestima, drugoj strani istog novčića kojom upravljaju mehanizmi koje su proučavali Allison i Honjo.
Ovogodišnji dobitnici Nobelove nagrade istraživali su dva tipa ovakvih kontrolnih mehanizama te su su postavili pitanje što bi se dogodilo kada bi se ti checkpointi i kočnice ipak isključile u kontekstu tumorskih bolesti. Istraživanja usmjerena davanju odgovora na ovo pitanje proveli su na modelu miša i na temelju dobivenih rezultata razvili novi koncept pristupa liječenju tumorskih bolesti. Stoga je i u formalnom obrazloženju nagrade iskazano kako im je dodijeljena za njihova otkrića u području terapije tumora temeljene na inhibiciji negativne imunološke regulacije.
Zašto bismo željeli isključiti mehanizme koji obustavljaju imunološki odgovor, zašto bismo željeli otpustiti tu kočnicu? Ideja je da tako prevarimo tumorsku stanicu koja je htjela prevariti nas maskirajući se, te ju svejedno uništimo. Zvuči komplicirano, no pokušat ću to objasniti u nekoliko rečenica. Krenimo od neto rezultata dobivenog otkrićima ovih dobitnika Nobelove nagrade. Danas na raspolaganju imamo antitumorske lijekove iz klase tzv. checkpoint inhibitora koje možemo podijeliti na 3 podgrupe prema tome na koju su molekulu usmjereni. Otkrića Dr. Allisona dovela su do razvoja podgrupe CTLA-4 inhibitora, dok su otkrića Dr. Honjo dovela do razvoja inhibitora druge dvije podgrupe, inhibitora molekule PD-1 i inhibitora molekule liganda PD-L1.
PD-1 je protein koji se nalazi na vanjskoj membrani stanica našeg imunološkog sustava te služi za prepoznavanje i razlikovanje naših stanica u odnosu na druge strane ili oštećene stanice. PD-L1 je molekula liganda koja se nalazi na površini raznih tumorskih stanica (a koju one stvaraju kako bi zavarale naš imunološki sustav) koja se može vezati na PD-1 receptor, inhibirati ga te tako spriječiti stanice imunološkog sustava da ju napadnu. Tako tumorska stanica ostaje nevidljiva našem imunološkom sustavu te nastavlja svoj maligni put. Kako riješiti ovaj problem? Treba onemogućiti kontakt PD-1 s PD-L1 i to pomoću molekula koje će ili „sjesti“ na PD-1 receptor ili se vezati na PD-L1 ligand i u oba slučaja inhibirati njihov direktni međusobni kontakt. Tako su stvoreni PD-1 i PD-L1 inhibitori koji onemogućuju tumorsku stanicu da provede svoj plan jer im je mehanizam kočnice koji ona želi prevariti korištenjem PD-1 liganda isključen te stanice imunološkog sustava napadaju bez obzira na sve. Prvi takav lijek (a zapravo se radi o antitjelima na molekule PD-1 ili PD-L1) ušao je u kliničko ispitivanje 2006 godine a prve terapije su u SAD odobrene tijekom 2014. godine.
Drugi princip checkpoint inhibitora je još kompleksniji te nadilazi informativnu razinu ovog članka pa ću reći kako se temelji se na drugoj molekularnoj interakciji u koju su uključene molekule CTLA-4 i CD80/86 na stanicama imunološkog sustava. Ukratko CTLA-4 molekula na površini T limfocita se veže na molekule CD80/86 na antigen prezentirajućim stanicama (APC) te tako inhibira aktivaciju T-limfocita što kao konačni učinak ima smanjivanje imunološkog odgovora. CTLA-4 inhibitori opet upadaju kao disruptori ovog kompleksa te tako sprečavaju da imunološki odgovor oslabi već ga se zapravo i stimuliraju da da svoj maksimum. U svojim in vivo istraživanjima na miševima Dr. Alison je pokazao kako je primjenom protutijela na CTLA-4 moguće eliminitati tumor u eksperimentalnim uvjetima. Prve terapije temeljene na ovom pristupu odobrene su u SAD 2011. godine (Slika 5) 3,4
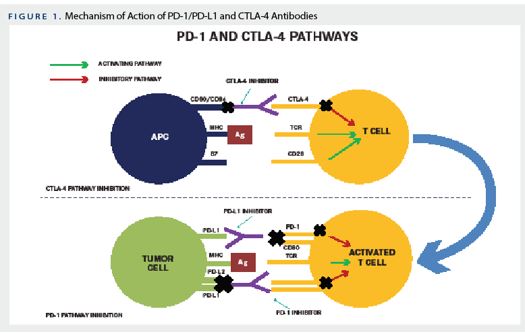
Danas je u primjeni niz checkpoint inhibitora temeljenih na ovim principima te ih je također priličan broj u različitim fazama kliničkih i pretkliničkih istraživanja i trenutno su jedan od vodećih smjerova u razvoju antitumorske terapije. Stoga je Nobelova nagrada sasvim zasluženo dodijeljena za ovo područje. Naravno kao i kod svih nagrada, ostaju znanstvenici koji su također dali značajan doprinos ovoj tematici a nisu ovogodišnji laureati. Za utjehu onima koji su izostavljeni jest ljudskost samog Dr. Honja koji je u jednoj od svojih izjava rekao kako ga je više od svake nagrade ganuo susret s čovjekom koji mu je pristupio u golf klubu te mu zahvalio na njegovom otkriću koje mu je omogućilo da ponovno igra golf nakon što mu je dijagnosticiran rak pluća.
I konačno značaj rada ove dvojice znanstvenika i njihovih timova jest i u tome što su nakon godina istraživanja imunologije tumora, još od početaka prošlog stoljeća, a koja su imala svoje uspone i padove te neko vrijeme i nisu bila u najužem fokusu a danas su vodeća područja s novim probojima u personaliziranoj terapiji, napravili značajan iskorak u opisivanju jednog od temeljnih antitumorskih mehanizama. Mehanizam check-point inhibicije se potencijano može primijeniti na različite tipove tumora jer ne ovisi o molekularnim promjenama koje se dogodile u samom tumoru kao što je to recimo slučaj s novim ciljanim ili kako se još zovu pametnim lijekovima, već se temelji na univerzalnom principu koji koristi naš imunološki sustav.
Na temelju istraživanja ovogodišnjih laureata danas je razvijena sasvim nova klasa antitumorskih lijekova koji su se pokazali uspješnima u terapiji tumora pluća, bubrega, limfoma i melanoma. Napredak koji je postignut u antitumorskoj terapiji je značajan, no nažalost kako se radi o izrazito snažnim mehanizmima imunološkog sustava reakcija koju oni izazivaju u organizmu odgovorna je i za jake i ozbiljne nuspojave ovih terapija što je ujedno i njihova mana uz cijenu koja je također značajna. Ipak, širenje spektra protutumorskih lijekova za čitave nove klase koje do otkrića ovih znanstvenika nisu postojale niti bile u primjeni, ohrabruje naša nastojanja da jednoga dana tumorske bolesti postanu kronične bolesti s kojima će ljudi moći živjeti kao i svi drugi kronični bolesnici.
1) Hanahan D, Weinberg RA (2000). “The Hallmarks of Cancer”. Cell. 100 (1): 57–70. doi:10.1016/S0092-8674(00)81683-9.
2) Hanahan D, Weinberg RA (2011). “Hallmarks of cancer: the next generation”. Cell. 144 (5): 646–74. doi:10.1016/j.cell.2011.02.013.
3) Ribas A, Wolchok JD (2018) Cancer immunotherapy using checkpoint blockade. Science 359 (6382): 1350-1355
4) https://www.nobelprize.org/prizes/medicine/2018/press-release/