biomedicina
CRISPR-Cas9: Niska učinkovitost revolucionarne tehnologije u primjeni na ljude. Ipak poboljšanja. Kako?
 Tamara Čačev / 22. srpnja 2022. / Članci / čita se 12 minuta
Tamara Čačev / 22. srpnja 2022. / Članci / čita se 12 minuta
 Tamara Čačev / 22. srpnja 2022. / Članci / čita se 12 minuta
Tamara Čačev / 22. srpnja 2022. / Članci / čita se 12 minuta

Tamara Čačev piše o pokusu na Novom Zelandu kojim se provjerava može li tzv. base editing na siguran način uvoditi promjene u jednom nukleotidu u naš genom i to unutar samog organizma i tako povećati učinkovitost tehnologije za koju je prije samo dvije godine dodijeljena Nobelova nagrada
CRISPR-Cas9 je zadnjih nekoliko godina postao atraktivan buzz-word o kojem možemo slušati i na američkim investicijskim podcastima. No, je li ta tehnologija uistinu zaživjela u svakodnevnici ili će se sve rasplinuti u poslovici „puno zuji malo meda daje“?
O osnovama ove tehnologije Ideje su pisale već prije nekoliko godina, zatim sam prigodno uz dodijelu Nobelove nagrade 2020. godine napisala tekst koji preporučam onima koje zanimaju osnove, no današnji tekst posvećen je napretku koji je ostvaren u međuvremenu, a neposredni povod je objava iz najnovijeg broja znanstvenog časopisa Nature o početku kliničkog pokusa u kojem se po prvi put koristi varijanta ove tehnologije kao genska terapija.1
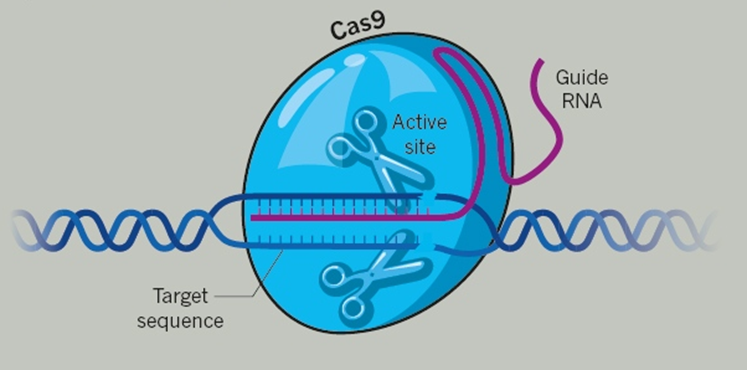
Točnije, radi se o tehnologiji koju nazivamo base-editing, modifikaciji izvorne ideje koja koristi neke elemete prvotne CRISPR-Cas9 tehnologije, ali o preciznijoj metodologiji za koju se smatra da bi bila pogodnija za primjenu u ljudi. Naime, pokazalo se kako CRISPR-Cas9 tehnologija koja je napravila revoluciju u znanstvenom svijetu i počela se masovno primjenjivati u znanstvenim istraživanjima ima i nekoliko nezanemarivih nedostataka zbog kojih je danas gotovo izvjesno da nikad neće u svojem osnovnom obliku zaživjeti u kliničkoj praksi. Ideja da se nefunkcionalni gen zamijeni funkcionalnim na način da se taj dio genoma izreže ‘molekularnim škarama’ i ubaci funkcionalna sekvenca čini se odličnom no pokazalo se kako zarezivanje oba lanca DNA izaziva i niz neželjenih i opasnih učinaka. Enzim Cas9 ima sposobnost pronalaženja točno određene sekvence u genomu na temelju onoga što mu zadamo putem konstruirane molekule RNA, tzv. vodiča. Kad pronađe ciljnu sekvencu u genomu, enzim siječe oba lanca molekule DNA a mehanizmi popravka stanice tu pukotinu popravljaju. No to se događa prilično neprecizno pa dolazi do ubacivanja ili gubitka nekoliko nukleotidnih baza što u konačnici rezultira time da čitava genska sekvenca bude neupotrebiljiva. Takav pristup je stoga dobar ako želimo ugasiti funkciju mutirane sekvence.
Korak dalje bilo je da se u cijeli sustav ubaci i predložak sekvence DNA prema kojem bi enzimi popravka ubacili željenu sekvencu na mjesto mutiranog gena, no pokazalo se kako je učinkovitost takvog sustava jako mala (manja od 5%), dok se ostatak lomova i dalje popravljao na isti način kao i prije. Također, početna euforija oko preciznosti navođenja sustava na točno određene sekvence u genomu se pokazala manje učinkovitom u praksi zbog mogućnosti neželjene ugradnje u dijelove genoma koji nisu bili ciljani što izaziva tzv. off-target učinke. Stoga je postalo jasno kako će se za primjenu u ljudima ovaj sustav morati učiniti preciznijim. Također, ponekad je korisno uništiti mutiranu kopiju gena daljnjim unosom grešaka, no u praksi je većinom ipak potrebnije iz nefunkcionalnog dobiti funkcionalni gen.
Danas se smatra kako postoji između pet i osam tisuća monogenskih bolesti uzrokovanih mutacijom. Kao da zbog pogreške u jednom slovu na nekoj stranici knjige od 3,5 milijarde znakova nismo u stanju pročitati cijelu knjigu
Ali, znanost ne miruje, i dok su se neki bavili ovom tehnologijom, skupina znanstvenika koju vodi dr. David Liu, razmišljala je kako zapravo možda ne treba zamijeniti čitav gen. U slučaju monogenskih bolesti bilo bi dovoljno napraviti samo preciznu preinaku određene pozicije, nukleotida koji je mutiran u slijedu DNA, kako bi se postigao učinak. Danas se smatra kako postoji između pet i osam tisuća monogenskih bolesti uzrokovanih mutacijom u samo jednoj bazi čitavog koda od 3,5 milijarde slova koje kodiraju naš organizam. Nažalost takva naizgled minimalna promjena može izazvati ogromnu štetu, od toga da bude nespojiva sa životom pa se embriji u ranoj fazi odbacuju, pa do toga da izaziva dugotrajnu životnu patnju te preranu smrt nositelja mutacije. To je zapravo kao da zbog pogreške u jednom slovu na nekoj stranici knjige od 3,5 milijarde znakova nismo u stanju pročitati cijelu knjigu. Naravno, u boljim varijantama životne lutrije, s nasljednim mutacijama se može živjeti uz primjerenu terapiju i kontinuirano praćenje. Neke se ne moraju nužno manifestirati u nositelja no ostaju i prenose se na potomstvo što također nije neka sreća. Za najveći broj monogenskih bolesti danas ne postoje adekvatna rješenja. Možemo misliti kako se radi o rijetkim pojavama, no iako svaka pojedina monogenska bolest može biti relativno rijetka u populaciji, sama ideja da ih ima na tisuće različitih ukazuje da one ipak predstavljaju javno-zdravstveni problem. Također, rijetkost monogenskih bolesti je relativan pojam, da navedemo samo primjer srpaste anemije koja je prilično rasprostranjena u afroameričkoj populaciji, značajno smanjuje kvalitetu života i čak dovodi do rasnih predrasuda o osobama koje od nje boluju kao onima koji će često izostajati s posla. Osim direktnog izazvanja bolesti od samog rođenja, ovakve promjene mogu povećati sklonost razvoju nekih bolesti koje se javljaju kasnije tijekom života poput nasljedne predispozicije za nastanak tumorskih bolesti. Svi ste vjerojatno čuli za gene BRCA 1 i 2 te njihovu vezu s pojavom karcinoma dojke koje je u medije uvela Angelina Jolie svojim osobnim primjerom.

No vratimo se base-editingu, primijetit ćete kako koristim ovaj pohrvaćeni termin iako vjerujem da se mnogima sada diže kosa na glavi, jer mislim kako je bolje koristiti izvorni oblik naziva ako se netko želi dalje informirati na internetu nego neki nasilu skovani hrvatski izraz. Ako je CRISPER-Cas9 sustav bio kirurgija, base-editing je laparoskopski pristup našem genomu. Dakle ideja je biti maksimalno poštedan i minimalno invazivan. To naravno dobro zvuči, no je li to provedivo?
Sljedeći korak u poboljšanju ove tehnologije bio je da se enzimu Cas9 onemogući cijepanje DNA već da se njegova sposobnost prepoznavanja sekvence upari s enzimom koji bi kemijski konvertirao bazu iz jednog tipa u drugi. Taj enzim naziva se base editor i otuda dolazi i naziv samog pristupa. Pioniri ovog pristupa bili su Dr. David Liu i njegov tim s Harvarda. Marljivi kroničari našeg genoma ustanovili su kako postoji više od 35 tisuća različitih točkastih mutacija koje su povezane sa nekom od klinički bitnih promjena. U kemijskom smislu, promjena T u C je potencijalno lakše ispravljiva (kako bismo povratili funkciju želimo vratiti natrag C u T) pa su Liu i suradnici krenuli od nje. Ono što se zapravo želi jest da se C pretvori u T, a u tome nam može poslužiti enzim deaminaza koji već postoji u živim organizmima i koji pretvara C u U, bazu koja je prisutna u RNA a koju stanična mašinerija u kontekstu DNA čita kao T (Slika 1).
Za razliku od prvotnog CRISPR-Cas9 pristupa u kojem enzim Cas9 radi lomove u oba lanca DNA, te se nastala pukotina ‘spontano’ popravljala korištenjem postojećih mehanizama stanice, ovaj pristup to ne zahtijeva, a to je vrlo bitno zbog potencijalnog uvođenja novih mutacijskih događaja kada se takvi dvolančani lomovi naprave u genomu. U slučaju base-editing tehnologije dolazi do zarezivanja samo jednog lanca i koristi se base-editor, kimerni enzim koji će kemijski modificirati nukleotidnu bazu iz jedne u drugu. Učinkovitost prvih verzija ovog novog sustava u in vitro uvjetima bila je oko 44%, no kada je sustav prebačen u stanice učinkovitost mu je bila manja od 8%.2 Problem je bio u tome da se modificirao samo jedan od lanaca DNA dok je u drugome ostajala nesparena baza koju je stanica i dalje popravljala nasumično, ponekad izrezujući modificiranu ciljnu bazu a ponekad njoj nasuprotnu staru nesparenu bazu. Trebalo je dakle mašineriju popravka genoma natjerati da i iz nasuprotnog lanca u dvostrukoj uzvojnici DNA ukloni bazu koja se sad više ne bi mogla spariti s novomodificiranom bazom, te ju zamijeni adekvatnom komplementarnom bazom. To je postignuto tako da base-editor zareže nemodificirani lanac te ga tako označi staničnoj mašineriji kao onaj koji treba popraviti. Na taj način uvedena promjena i „zacementirana“ za svaki sljedeći ciklus umnažanja DNA. No, promjene T u C i G u A čine tek manje od 15% prije spomenutih mutacija, većina promjena koje su povezane s nekim bolesnim stanjima zapravo su G u A i C u T.
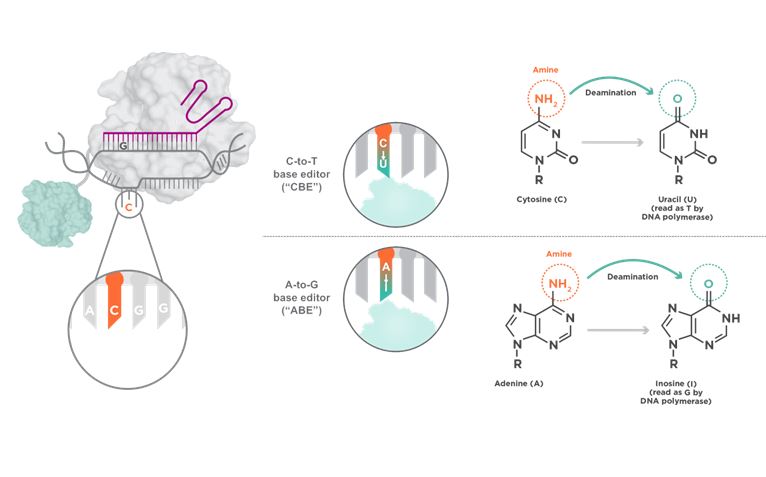
No, u živim organizmima ne postoji enzim koji bi mogao konvertirati A u G i T u C u molekuli DNA te je ispravljanje ovakve promjene već na razini ideje bilo puno veći izazov. Ipak u laboratoriju Dr. Liu uspijeli su napraviti enzim koji deaminira adenozin (A) u inozin (I) kojeg DNA polimeraza čita kao gvanin (G), te su pokazali kako je na sličan način kako je prethodno opisano moguće napraviti korekciju i ovakvih promjena (slika 1).
Sada kada znamo koliko se prepreka moralo preskočiti kako bi ova tehnologija došla do razine potencijalne primjene u genskoj terapiji ljudi postaje jasno zašto je Nature ovu vijest prenio kao jedno od većih uspjeha ovog mjeseca. Već je bilo pokušaja korištenja base-editing tehnologije na životinjskim modelima tirozinemije, beta-talasemije, mišićne distrofije, fenilketonurije, prirođene gluhoće, također, u različitim fazama kliničkih pokusa su neke terapije koje se temelje na ex vivo modifikaciji stanica te njihovom vraćanju u organizam, a ova tehnologija se koristila i u agronomskim modifikacijama usjeva.
No, sada se radi o važnoj prekretnici, uključivanju prvog sudionika u klinički pokus na Novom Zelandu kako bi se provjerilo da li base-editing može na siguran način uvoditi promjene u jednom nukleotidu u naš genom i to unutar samog organizma. U ovom ispitivanju koristit će se base editor koji konvertira adenin u guanin u genu za protein PCSK9 koji je gen koji regulira razine kolesterola u krvi. Ovaj test je rezultat tehnologije koju je razvila biotehnološka tvrtka Verve Therapeutics iz Massachussettsa a ideja je da se smanji razina funkcionalnog PCKS9 u osoba koje boluju od heterozigotne nasljedne hiperkolesterolemije. Ove osobe imaju kronično povišene razine kolesterola u krvi koje u konačnici dovode do razvoja bolesti srca i krvožilnog sustava. Kada se ovaj protein onesposobi, dolazi do smanjenja razine kolesterola te se može očekivati smanjeni rizik obolijevanja od srčanih bolesti a u kliničkoj primjeni su već neke konvencionalne terapije koje smanjuju aktivnost ovog proteina pa je ispravnost ovog pristupa pokazana. Također su provedeni pokusi na majmunima makakima na kojima se ovom tehnologijom postiglo smanjenje u razini PCSK9 za 81% te smanjenje kolesterola u krvi te se utvrdilo da je ovakav tretman siguran (koliko može biti u okolnostima prvog ikad ovakvog postupka). Ono što je najbitnije u ovom kliničkom istraživanju jest utvrditi da li se događaju off-target promjene tijekom primjene ove terapije u čovjeka. Ipak, čak i u tom slučaju, možda bi takvi učinci bili podnošljivi u kontekstu dobrobiti za ljude koji pate od ove bolesti, no proći će sigurno još dosta vremena da ova terapija zaživi u široj primjeni.
U ovom kliničkom pokusu doći će do modifikacije DNA direktno u stanicama tijela. Molekule mRNA koje će služiti kao predložak za sintezu editorskog enzima kao i komadić RNA koji će usmjeravati enzim na lokaciju modifikacije bit će ubačene upakirane u lipidne nanočestice (kao i mRNA cjepivo za SARS-CoV-2). Pretpostavlja se da će se čestice zaustaviti u jetri što je inače mana za neke druge terapije nanočesticama jer je to mehanizam kako se organizam njih rješava, ali će ovdje to biti uredu budući da se PCSK9 proizvodi u jetri. Za primjene u nekim drugim ciljnim tkivima, najvjerojatnije će trebati izdvojiti stanice iz tog tkiva oboljelog, modificirati ih te vratiti natrag u organizam.
Kasnije tijekom ove godine očekuje se početak drugog kliničkog ispitivanja temeljenog na base-editing tehnologiji a koje bi uključivalo oboljele od srpaste anemije koje će se upravo temeljiti da modifikaciji stanica koštane srži i njihovom vraćanju. Rezultati oba klinička ispitivanja očekuju se iduće godine a paralelno se očekuju i rezultati nekih CRISPER-Cas9 ispitivanja.
Problem off-target učinaka, odnosno potencijalnih modifikacija baza koje se nalaze u sličnim sekvencama koje Cas-9 nije u stanju razlikovati također postoji ali su u međuvremenu razvijene i varijante Cas9 s većom specifičnošću kao i drugi pristupi kojima se ograničava vremenski period perzistiranja mašinerije za ovaj tip modifikacija u stanici. Također, znanstvenici iz područja u međuvremenu su počeli testirati i druge enzime koji bi potencijalno mogli imati manje off-target učinaka, bilo da se radi o enzimima izoliranim iz već postojećih organizama ili o njihovim modifikacijama. Sve je izglednije da će odabir enzima ovisiti i o organizmu i tipu stanica u kojima se treba napraviti korekcija genoma. Također se mora riješiti i pitanje manje pristupačnih regija u genomu, no to je voće s visokih grana, a još je mnogo niskih ostalo neubrano.
Terapijske aplikacije base editora, koji se još nazivaju i molekularnim strojevima, u teoriji su široke, osim korekcije točkastih mutacija koje izazivaju bolest, modifikacija gena mogla bi ići i u smjeru dobivanja protektivnih varijanti istog gena, primjerice onih kod kojih je manja vjerojatnost da će osoba razviti neku od multigenskih bolesti, aktivacije ili utišavanja ekspresije gena ili čak intervencije na više mjesta u genomu. No ove tehnologije i dalje imaju jednu od ključnih prepreka u njihovoj širokoj primjeni. Jasno je da bi u odrasloj dobi trebalo napraviti korekciju genoma u gotovo svim stanicama organizma što današnjim metodama unosa ovih konstrukata nije moguće. Stoga je fokus trenutno na rješavanju onih bolesti gdje bi se ispravljanjem genoma već manjeg broja stanica, pa makar i kontinuiranim odlaskom oboljelih na gensku terapiju u nekim vremenskim razmacima ipak moglo postići bolje funkcioniranje organizma. To su najčešće slučajevi kada je i manja količina nekog funkcionalnog proteina lokalizirana u nekom tkivu dovoljna da osoba osjeti benefit takve takve terapije.