Nobelova nagrada za kemiju 2020
Emmanuelle i Doudna dobitnice Nobela za otkriće genetskih škara, ali nagrada je premalo za sve zaslužne. Sudski sporovi
 Tamara Čačev / 9. listopada 2020. / Članci / čita se 12 minuta
Tamara Čačev / 9. listopada 2020. / Članci / čita se 12 minuta

 Tamara Čačev / 9. listopada 2020. / Članci / čita se 12 minuta
Tamara Čačev / 9. listopada 2020. / Članci / čita se 12 minuta

Ovogodišnje laureatkinje su prve publicirale otkriće, sedam mjeseci prije Feng Zhanga koji je međutim u svojem radu pokazao kako ovaj sistem može funkcionirati i unutar stanica eukariotskih organizama u koje spadaju biljke, životinje i čovjek, što u primjeni ima puno veću težinu (a to omogućava i izdašne kompenzacije vlasnicima patenta). To je urodilo s nekoliko sudskih procesa u kojima od prošlog mjeseca 'vodi' Zhang i njegova grupacija, piše Tamara Čačev o Nobelovoj nagradi za kemiju
Nije čest slučaj da se Nobelova nagrada dodjeljuje samo osam godina od nekog znanstvenog otkrića kao što je to s ovogodišnjom nagradom za kemiju. Više je zdravorazumskih razloga za to, a znanstvena zajednica uglavnom nije ni svjesna koliki će utjecaj neko otkriće imati na znanost i društvo. Nepisano je to pravilo koje je ponekad i okrutno, jer mnogi zaslužni ne dožive tu čast. S druge strane, iz primjera Nobelovih nagrada za mir, pa i nekih za znanost, ponekad se pokaže da su možda bile preuranjene.
Ovogodišnji dobitnice Nobelove nagrade za kemiju su Emmanuelle Charpentier i Jennifer A. Doudna za otkriće ‘genetičkih škara’. Riječ je o prirodnom fenomenu koji su modificirale u primjenjivu tehnologiju koja je u kratkom vremenu omogućila ogromne iskorake na području tzv. life sciences u temeljnim istraživanjima ali i s velikim potencijalom translacije u područje primjenjive biomedicine. O ovoj tehnologiji već su za Ideje.hr pisali moji kolege, a radi se o RNA-vođenom CRISPR-Cas9 sustavu kojim se može ciljano uređivati genom živih bića i mikroorganizama s do sada neviđenom preciznošću. Stoga nije iznenađujuće da se ova tehnologija nakon brzog širenja u temeljnoj znanosti u rekordnom roku našla i u tzv. translaciji, odnosno prijenosu znanstvenih spoznaja u konkretne primjene, od razvoja novih ciljanih terapija u medicini do stvaranja novih genetički modificiranih organizama u agronomiji. Ukratko, od ovog se znanstvenog otkrića vrlo brzo vidio i svjetovni učinak. Već je i prije bilo govora kako ovo otkriće zaslužuje Nobelovu nagradu, no kako je u njemu bilo više sudionika, postojali su, i još postoje, prijepori tko je zaslužniji. Kao što znamo, Nobelova nagrada ima limitiran broj osoba koje mogu dijeliti jedno priznanje. Bilo je ideja da se otkriće pokrije nagradom za medicinu ili fiziologiju te nagradom za kemiju i danas svjedočimo djelomičnoj realizaciji tog scenarija.
Kako je primjena bila brza s osjetnim financijskim kompenzacijama već u startu (a o budućnosti da i ne govorimo) povela se i sudska bitka oko toga tko ima pravo na patent. Naime ovogodišnje laureatkinje su prve publicirale dokaze kako ovaj sistem može ciljano rezati molekule DNA i to su objavile 2012. godine i to sedam mjeseci prije trećeg sudionika ove priče Feng Zhanga koji je neovisno došao do istih spoznaja. No, iako je zakasnio, Zhang je u svojem radu pokazao kako ovaj sistem može funkcionirati i unutar stanica eukariotskih organizama u koje spadaju biljke, životinje i čovjek, što u smislu primjene ima puno veću težinu. To je urodilo s nekoliko sudskih procesa u kojima od prošlog mjeseca ‘vodi’ Zhang i njegova grupacija jer im je priznato pravo na otkriće primjene ovog sustava u eukariotima što se smatra komercijalno važnijom primjenom. Stoga je i bilo iznenađenje da ga je zaobišla Nobelova nagrada, kao i neke druge zaslužne znastvenike koji su dali doprinos ovom otkriću poput Francisca Mojica koji je s dvije znanstvenice podijelio Albany Medical Center medicine prize 2017 godine, ili Virginijusa Šikšnysa koji s njima dijeli nagradu Kavli iz 2018. godine.
Zamislite svijet u kojem je moguće izrezati sve loše (mutirane) dijelove genoma koji izazivaju bolest i patnju. Naravno, ima i onih koji zamišljaju svijet s još većim kravama koje daju više mlijeka ili mesa kao i usjeve otporne na štetnike
No vratimo se s milijunskih iznosa na znanost. Čemu služe CRISPR/Cas genetičke škare? Služe tome da ciljano modificiramo genome organizama u različite svrhe i to u roku koji može biti i svega nekoliko tjedana. Zašto bismo to radili? Zamislite svijet u kojem je moguće izrezati sve loše (mutirane) dijelove genoma koji izazivaju bolest i patnju. Naravno, ima i onih koji zamišljaju svijet s još većim kravama koje daju više mlijeka ili mesa kao i usjeve otporne na štetnike. Što će od toga stvarno i biti pokazat će vrijeme pred nama, no sasvim je sigurno da je preciznost i brzina koja se dobiva ovom tehnologijom bez presedana. Stvari koje se danas rade zahvaljujući CRISPR-Cas9 sustavu do prije par godina nije bilo moguće ni sanjati, a ako bi se poneki znanstvenik i uputio na ovaj put modifikacije genoma nekog složenijeg organizma s neizvjesnim ishodom, morao je računati s godinama mukotrpnog rada. Bezbrojne mogućnosti korištenja ovog sustava, njegova relativna lakoća i brzina primjene, koja istina nije sasvim bez mana, sigurno će promijeniti svijet koji poznajemo.
Krajem 80-tih analizom genoma različitih bakterija uočene su regije od 30-tak nukleotida koje su se ponavljale a između kojih su bile druge isto tako sačuvane sekvence. Tada je iskovan i naziv CRISPR, skraćenica za engl. clustered regularly interspaced short palindromic repeats.
Zatim su otkriveni tzv. CRISPR-associated (cas) geni u blizini ovih regija. Ovi su geni kodirali za proteine koji su u svojoj strukturi sadržavali elemete koje obično imaju proteini koji sudjeluju u metabolizmu molekule DNA, odnosno u genskoj ekspresiji. No, uloga ovih sekvenci i proteina bila je nepoznata do 2005. kada je uočeno da CRISPR sljedovi štite neke bakterije od infekcija, odnosno ulaska strane DNA virusa te u neku ruku predstavljaju sistem prepoznavanja prijašnjih susreta sa zaraznim čimbenikom.
Kažu kako u znanosti kao i u svemu drugome treba imati i malo sreće i biti u pravo vrijeme na pravom mjestu ili pogoditi zlatnu žilu, ili što se već kaže kada se nekome nenadano otvore vrata za koja trenutak prije nije znao niti da postoje. No takav trenutak treba znati i prepoznati. To se dogodilo, kako je i sama priznala citirajući Louisa Pasteura (Dans les champs de l’observation le hasard ne favorise que les esprits préparés) Emmanuelle Charpentier kada je prilikom rada na bakteriji Streptococcus pyogenes (kolokvijalno poznatoj kao bakterija koja proždire meso jer može izazvati sepsu i raspadanje mekog tkiva) otkrila dotad nepoznati oblik molekule RNA – tracrRNA za koju se kasnije ispostavilo da djeluje u svojevrsnom obrambenom sustavu bakterije protiv virusa i dio je većeg sustava koji danas poznajemo pod imenom CRISPR/Cas (Slika 1).
Virusi prilikom infekcija bakterija unose nukeleinske kiseline svoga genoma jer im bakterija služi kako tvornica za vlastitu reprodukciju. Znamo da se virusi ne mogu samostalno umnažati nego koriste mašineriju živih stanica kako bi odradili ovaj dio svog životnog ciklusa. No, i bakterije se mogu braniti na način da ukoliko prežive infekciju ubace dio viralnog genoma u svoj genom u regiju CRISPR i tako nastaje CRISPR DNA koja služi kao kalup za stvaranje njoj komplementarnih RNA. Na tu se CRISPR RNA zatim veže tracrRNA i protein Cas9. Protein Rnaza III djeluje kao molekularne škare i reže molekulu CRISPR RNA u dijelove. Time je je završeno stvaranje genetičkih škara koje čini kompleks u kojem se nalazi protein Cas9, dio viralne sekvence, tracerRNA i druge komponente. Takve genetičke škare pri idućem susretu mogu prepoznati genom virusa i uništiti ga te obraniti bakteriju od infekcije. Iako se ne radi ni o približno sličnim mehanizmima, možemo ovdje napraviti usporedbu genetičkih škara s imunosnim sustavom životinja koji također ima ulogu u sprečavanju infekcija.
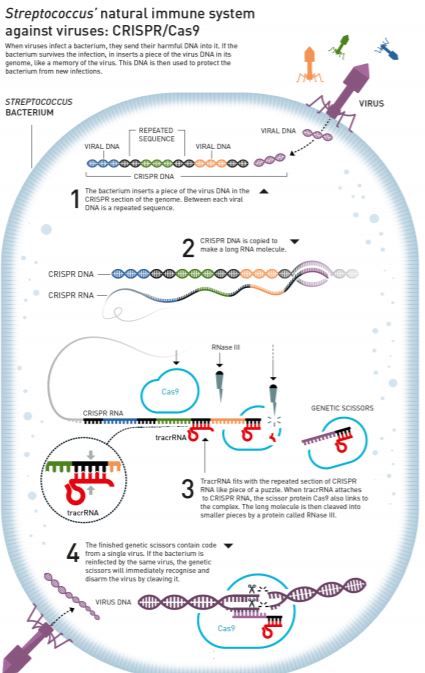
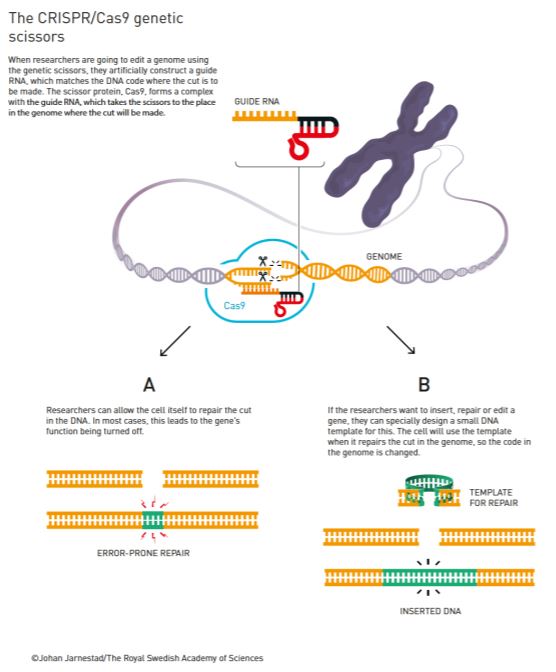
Svoja prva otkrića objavila je 2011. godine te je uspostavila suradnju s drugom ovogodišnjom laureatkinjom Jennifer Doudna. U to vrijeme nekoliko se grupa bavilo istraživanjem ovih sustava na različitim bakterijama i do 2011. godine postalo je jasno kako je ovaj mehanizam obrane bakterija prilično raširen kao svojevrsni adaptivni imunosni sistem kojim se one rješavaju virusa i stranih plazmida. No, zahvaljujući suradnji ovih dvaju znanstvenica ovaj sustav cijepanja molekule DNA uspješno je prebačen u in vitro uvjete i pojednostavljen kako bi se mogao primjenjivati u laboratoriju. Pojednostavljeno, korištenjem znanja o CRISPR-RNA i tracrRNA osmislile su tzv. guide RNA u kojoj su objedinile funkciju ove dvije molekule i na taj način pojednostavnile osnovni sustav za potrebe korištenja in vitro. Zatim su ovaj sustav dodatno modificirale kako bi umjesto svoje nativne uloge u cijepanju virusa mogao biti kontrolirano usmjeren na cijepanje bilokoje molekule DNA na točno određenom mjestu (Slika 2). Ovaj pojednostavljeni ali i usmjereniji sustav CRISPR/Cas9 sastoji se od molekule RNA koja ima sekvencu koja odgovara sekvenci koju treba zarezati u ciljnoj molekuli DNA i koja navodi (zato se i zove guide RNA) protein Cas9 do tog mjesta u genomu.
Nakon zarezivanja ciljne sekvence u genomu, stanica popravlja rez ali s greškama koje izazivaju gubitak funkcije gena u kojem je došlo do rezanja molekule DNA. Na taj način zapravo isključujemo funkciju ciljnog gena što ponekad može biti korisno, primjerice u tumorima isključiti mutirane gene koji uzrokuju njihovo nekontrolirano umnažanje. Korak dalje u ovoj metodi jest kada želimo da se na mjesto reza ubaci neka nova sekvenca DNA. Tada se u stanicu unosi i tzv. kalup koji će stanica koristiti pri popravku reza. Kako je na kalupu sekvenca koju želimo ubaciti u genom, nakon popravka ćemo na mjestu reza imati ubačenu željenu sekvencu. To pak može biti korisno ako želimo zamijeniti mutirani gen s funkcionalnim, primjerice kod monogenskih nasljednih bolesti, naprosto zamijenimo defektni gen sa njegovom „zdravom“ verzijom.
Nakon inicijalnih radova ove dvije znanstvenice, tehnologija je primijenjena u nizu eukariotskih organizama in vivo, primjerice u kvascu, vinskoj mušici i biljci Arabidopsis thaliana, koji se koriste kao modelni organizmi za istraživanja u molekularnoj biologiji. Danas je poznato i više oblika proteina Cas koji se koriste u svrhe uređivanja genoma. Ova metodologija danas se primjenjuje za modifikaciju usjeva i korištena je primjerice za stvaranje riže koja u manjoj mjeri apsorbira teške metale iz zemlje na kojoj raste. Također je korištena za modifikaciju biljaka kako bi bolje podnosile sušu, bile otpornije na insekte i druge štetnike protiv kojih bi se inače trebali korisititi pesticidi.
Što se tiče primjene ovog sistema u medicini, on se koristi u razvoju novih imunoterapija za tumorske bolesti kao i nekih nasljednih bolesti. U tijeku su klinička istraživanja u kojima se ova tehnologija primjenjuje za modifikaciju hematopoetskih matičnih stanica u liječenju srpaste anemije i beta-talasemije. No, treba biti oprezno optimističan budući da ova tehnologija nije bez svojih mana i tek ćemo u budućnosti vidjeti što će od ovih primjena na čovjeku uistinu i zaživjeti.
Jasno je da ova tehnologija otvara i mnoga etička i društvena pitanja te da pravna regulativa kaska za mogućnostima koje pruža u trajnom i nasljednjom mijenjanju genoma organizama uključujući i čovjeka
Također treba spomenuti da su prije ovog otkrića velike nade bile polagane u primjenu sistema koji bi ciljano prema sekvenci cijepali DNA a bili su temeljeni na DNA ZNF i TALEN nukleazama no oba sistema nisu zaživjela u praksi jer se pokazalo da je njihova primjena izazivala puno problema u dizajnu, sintezi i validaciji eksperimenata. Dana Carroll bila je pionirka ove tehnologije no i nju je Nobelova nagrada mimoišla iako je zapravo bila među prvima koja je otvorila polje ciljanog uređivanja genoma genetičkim škarama.
I na kraju, možemo ovo otkriće usporediti s onim Kary Banks Mullisa koji je osmislio metodu lančane reakcije polimerazom (PCR, kratica za tehnologiju koju je vjerojatno zbog testiranja na COVID danas usvojio svatko od nas). Za to je također relativno brzo dobio Nobelovu nagradu 1993. godine a revolucija koju je ovo otkriće napravilo u biomedicini i znanostima o životu kako u istraživanjima tako i u konkretnoj primjeni dovela je do toga da govorimo o dvije epohe – prije i poslije PCR tehnologije. Istina, ovog ‘prije’ se sada prisjećamo kao da se radilo o srednjem vijeku a ne o vremenu prije kojih 40-tak godina. Učinak ovog otkrića na naš život (od molekularne dijagnostike do umnažanja genoma u forenzici, biotehnologiji, farmaceutici, agromomiji, veterini, ekologiji…) takav je da bi zaslužilo i deset ovakvih nagrada. U svijetu ne postoji laboratorij iz ovih područja u kojem danas ne postoji barem nekoliko PCR instrumenata i to je molekularnim biolozima postalo apsolutno neophodno sredstvo za rad. E, vidite, smatra se da će otkriće CRISPR/Cas sustava imati sličan ako ne i veći učinak na čovječanstvo. Jasno je također da ova tehnologija otvara i mnoga etička i društvena pitanja te da pravna regulativa kaska za mogućnostima koje ova tehnologija pruža u trajnom i nasljednjom mijenjanju genoma organizama uključujući i čovjeka o čemu sam već i prije pisala za Ideje.hr.
O laureatkinjama:
Emmanuelle Charpentier (1968.) je Francuskinja koja je doktorirala na Pasteurovom institutu u Parizu 1995. godine. Tijekom karijere radila je na desetak znanstvenih institucija u pet zemalja a danas je voditeljica znanstvene jedinice za patogene pri Max Plancu u Berlinu. Inicijalni interes su joj bila istraživanja bakterijske rezistencije te pronalazak novih mehanizama za razvoj antibiotika.
Jennifer A. Doudna (1964.) je rođena u SAD gdje i danas živi. Doktorirala je 1989. godine na Harvardu i profesorica je pri Kalifornijskom sveučilištu i radi na institutu Howard Hughes. U znanosti je prije ovog otkrića bila prepoznata u području interferencijskih RNA mehanizama.
Cohen J. The latest round in the CRISPR patent battle has an apparent victor, but the fight continues. (online, rujan 2020) https://www.sciencemag.org/news/2020/09/latest-round-crispr-patent-battle-has-apparent-victor-fight-continues doi:10.1126/science.abe7573
Cohen J. CRISPR, the revolutionary genetic ‘scissors,’ honored by Chemistry Nobel. https://www.sciencemag.org/news/2020/10/crispr-revolutionary-genetic-scissors-honored-chemistry-nobel?utm_campaign=SciMag&utm_source=JHubbard&utm_medium=Facebook
Ledford H, Callaway E. Pioneers of revolutionary CRISPR gene editing win chemistry Nobel. https://www.nature.com/articles/d41586-020-02765-9