molekularna biologija i medicina
Čudesni svijet eksosoma. Čak ako i brane tumorsku stanicu od terapije, još uvijek to otvara nove mogućnosti liječenja
 Tamara Čačev / 16. srpnja 2020. / Perspektive / čita se 10 minuta
Tamara Čačev / 16. srpnja 2020. / Perspektive / čita se 10 minuta
 Tamara Čačev / 16. srpnja 2020. / Perspektive / čita se 10 minuta
Tamara Čačev / 16. srpnja 2020. / Perspektive / čita se 10 minuta

Eksosomi su „mjehurići“ koje proizvode stanice gotovo svih organizama. Smatralo se da predstavljaju način na koji se stanica rješava otpadnih produkata, no danas znamo da se radi i o načinu na koji stanice međusobno komuniciraju, piše Tamara Čačev. Kako se i u nizu bolesti pojavljuje specifični oblik komunikacije eksosomima, možda se otvaraju nove mogućnosti eksosomske dijagnostike i terapije
Kada sam prije kojeg desetljeća izabrala molekularnu biologiju kao fakultet koji želim studirati, kao što ovih dana biraju neki novi studenti, činilo mi se kako se radi o području pred kojim je budućnost. Sjećate li se onih reklama s posterom malog djeteta iznad kojeg piše ona/on će se baviti zanimanjem koje danas još ne postoji. Ne mogu reći da u doba kada sam se rodila nije postojala molekularna biologija, no njen je doseg u primjeni svakako bio vrlo limitiran. U to je doba tek stvorena metoda sekvenicranja molekula DNA. PCR, o kojem danas toliko pričamo zbog testova na COVID-19, nije bio ni u primisli, a metoda kojom se danas testira nije postojala dok sam studirala.
I upravo ta dinamičnost molekularne biologije me i privukla tom studiju i svaki mi radni dan čini zanimljivim. Istina, znanje se generira sve većom brzinom koju je teško pratiti, novosti i preokreti u paradigmama događaju se svakih nekoliko godina, i to ponekad stvarno može biti frustrirajuće. Jer kad već pomisliš: „to je to, nema sad tu više ničeg novog što bi se moglo dodati“, iskrsne neki novi komadić spoznaje koji nas natjera da presložimo čitavu sliku.
Jedno od takvih stvari jest i otkriće eksosoma, „mjehurića“ (30-150 nm u promjeru) obavijenih lipidnom dvoslojnom membranom koje proizvode stanice gotovo svih organizama. U njih su upakirane različite biološke molekule koje na ovaj način izlaze van stanice u izvanstanični prostor te se prenose kroz organizam ali često i izvan njega.1 Otkrili su ih i imenovali Trams i Johnstone 1986. godine u kulturi stanica eritrocita ovce. Ovom se nalazu nije pridavala posebna važnost sve dok, desetak godina kasnije, nije utvrđena uloga eksosoma u induciranju jednog tipa antigen-specifičničnog odgovora T- limfocita što je bilo od velikog značaja za istraživanja u imunologiji. Konačni zalet ovom području dala je Nobelova nagrada za fiziologiju ili medicinu 2013. godine koja je dodijeljena Rothmanu, Schekmanu i Sudhofu za rasvjetljavanje mehanizama unutarstaničnog transporta pomoću vezikula.
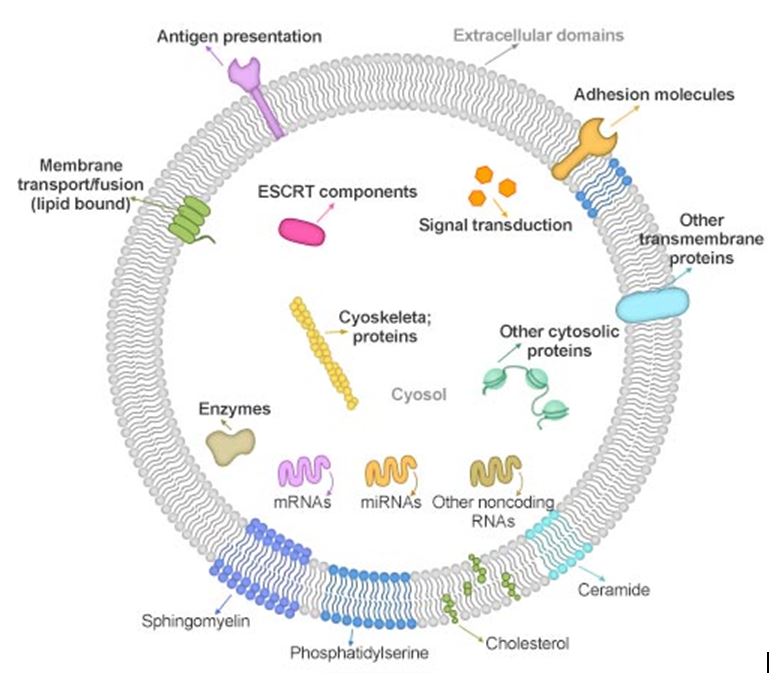
Danas o građi eksosoma još ne znamo dovoljno osim da je vanjska membrana bogata kolesterolom, sfingolipidima, ceramidima te drugim gliko- i fosfolipidima. Od proteina koji su zastupljeni u membrani eksosoma nalazimo MHC I (bitan u imunološkom odgovoru), heat-shock proteine (odgovor stanica na stres), zatim molekule CD9, CD63, CD81 i slične koji predstavljaju transmembranske proteine bitne za međustanično prepoznavanje. Ovi proteini su karakteristični za eksosome pa ih stoga nazivamo i eksosomalnim biljezima (Slika 1).
Smatra se kako jedna ljudska stanica proizvede od 1000 do 10000 eksosoma. Na taj način stanica koja ih proizvodi u svoju okolinu otpušta točno određene proteine, lipide, mRNA, miRNA i DNA. Nekad se smatralo da predstavljaju način na koji se stanica rješava svojih otpadnih produkata, no danas znamo da se osim ove funkcije radi o načinu na koji stanice međusobno komuniciraju na daljinu i to u nizu bioloških procesa koji se odvijaju u zdravom organizmu. Danas je poznato da se i u nizu različitih bolesti, poput primjerice tumorskih, također pojavljuje specifični oblik komunikacije eksosomima koji se javljaju kod nekih tipova tumora. Ako pomoću eksosoma primjerice tumorske ili neke druge „bolesne“ stanice komuniciraju, možda je moguće vanjskim djelovanjem, odnosno razvojem eksosomalne terapije na njih djelovati u svrhu liječenja. Iz svega toga proizlazi kako se otkrivanjem uloge eksosoma otvaraju nove mogućnosti dijagnostike i terapije bolesti i to ne samo čovjeka već i drugih organizama, primjerice biljaka koje nam često nisu u fokusu.
Zasad se kao jedna od najznačajnijih uloga eksosoma ističe prijenos specifičnih molekula RNA u stanice primateljice gdje zatim ta RNA utječe na sintezu proteina. Utjecaj na sintezu proteina u stanici znači zapravo utjecaj na njenu funkciju. Stoga je interesantan koncept da neka udaljena stanica na drugom kraju organizma može na ovaj način utjecati na funkcioniranje neke stanice koja primi sadržaj eksosoma. Do sada su u tom kontekstu identificirane različite mikroRNA molekule kao i dugačke nekodirajuće molekule RNA (engl. long noncoding RNAs). No, nisu samo regulatorne molekule RNA tipa teret koji se prenosi eksosomima. U njih mogu biti upakirani i proteini poput različitih proteina koji sudjeluju u prijanjanju stanica, membranskom transportu ili reakciji na stres. Oni direktno djeluju na ciljne stanice i bez potrebe utjecanja na sintezu proteina pa je takav utjecaj brži i izravniji u smislu postizanja učinka na ciljnu stanicu.
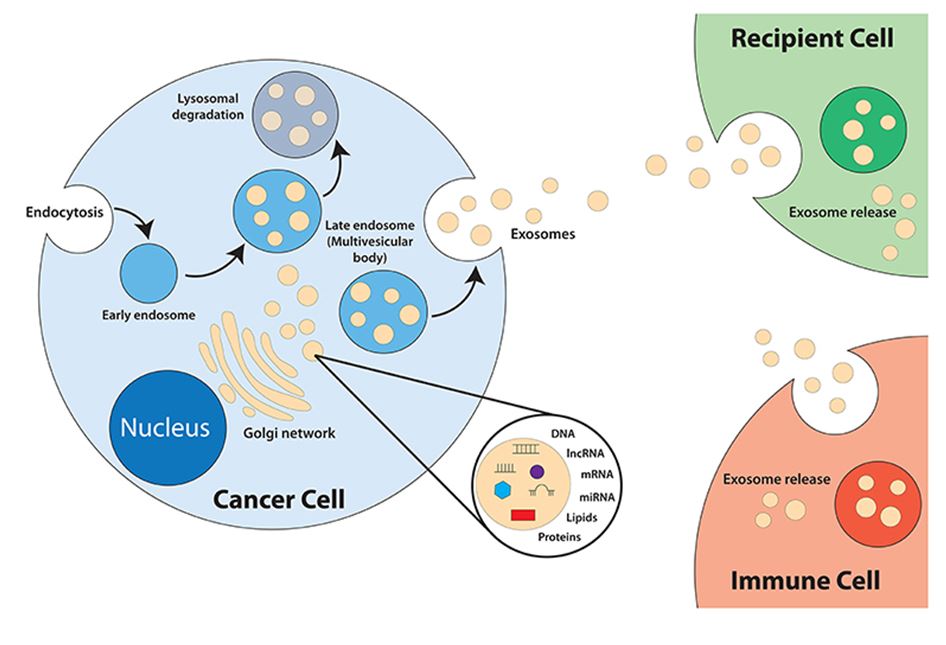
Kako nastaju eksosomi nije još do kraja razjašnjeno, no ono što se do sada saznalo jest da nastaju unutar stanica u tvorevinama koje nazivamo multivezikularnim tjelešcima jer sadrže više takvih mjehurića. Zatim se od tih tjelešaca odvajaju pojedini mjehurići (vezikule) koje se spajaju s vanjskom membranom stanice te na taj način izlaze iz nje (Slika 2). Ovo može izgledati trivijalno, no naravno da nije budući da moramo imati na umu kako se u stanici u svakom njenom dijelu i u svakom trenutku nalazi na milijune različitih molekula te stoga pakiranje točno određenih molekula u točno određene čestice nije nimalo jednostavno. Usporedimo to primjerice s pokušajem da na centralnoj ulici New Delhija neki taksist pokušava pronaći točno određenog putnika kojeg mora odvesti na točno određeno mjesto bez nama poznatih načina navigacije.
Čovjek se pita a zašto je to uopće bitno, pa i tako sve naše stanice funkcioniraju a da mi ne znamo što se u njima događa. To je često prisutno kod razmatranja fundamentalnih istraživanja u široj zajednici, čak bih se usudila reći i među kolegama koje naginju više primjenjivoj znanosti, bližoj komercijalizaciji. Razlog zašto se ovakvi procesi moraju rasvijetliti jest da bez njihovog potpunog razumijevanja nema ni mogućnosti njihove manipulacije na kontrolirani način što je bitno za razvoj novih terapija.
No, vratimo se eksosomima. Kada dođu do stanice recipijenta putem endocitoze (spajanja s membranom stanice domaćina) ili ciljano putem receptor-ligand interakcije, dolazi do unošenja sadržaja eksosoma u citoplazmu stanice primateljice. Zatim tako donešene regulatorne molekule obavljaju svoju ulogu, a iskorišteni eksosomi se opet mogu formirati u multivezikularna tjelešca ili fuzionirati direktno s membranom stanice za neki idući ciklus.
Do sada se uloga eksosoma istraživala na čitavom spektru bolesti, najviše na tumorima, neurodegenerativnim, kardiovaskularnim te drugim bolestima kao i imunološkom odgovoru organizma.
Tumori komuniciraju sa svojom mikrookolinom te šalju signale i prema udaljenim dijelovima tijela. Primjerice u nekim tipovima tumora upravo signali primarnog tumora drže metastaze pod kontrolom. Uloga eksosoma u tumorskim bolestima istraživana je u kontekstu njihove uloge u staničnoj komunikaciji na daljinu koja je bitna za proces metastaziranja. Smatra se da eksosomi možda imaju ulogu u preferencijalnom topičkom metastaziranju pojedinih tipova tumora u pojedine organe. Također pokazalo se kako eksosomi mogu sudjelovati u razvoju rezistencije na terapiju kao i u razvoju novih krvnih žila u okolini tumora koje su neophodne za njegov rast i širenje. Kod razvoja rezistencije na antitumorsku terapiju pretpostavlja se da je uloga eksosoma u tome da u sebe pakiraju terapijski agens te ga izbacuju iz tumorskih stanica.2 Također u ovo vrijeme interesantan je odgovor stanica na infekciju mikroorganizmima pri kojem dolazi do otpuštanja eksosoma s protektivnom ulogom tijekom infekcije.
Molekule prisutne u eksosomima mogu se iskorisititi i kao biomarkeri, odnosno svojevrsni indikatori za prisutnost neke promjene u organizmu. Kako sadržaj eksosoma određuje stanica od koje se oni odvajaju jasno je da će molekularni profil eksosoma sličiti upravo stanici od koje su potekli. Kako se radi o mjehurićima obavijenim membranom, njihov je sadržaj prilično stabilan te otporan na vanjske utjecaje i potencijalne čimbenike koji bi ga mogli uništiti. Oni ostaju stabilni i tijekom njihovog izdvajanja iz organizma te su relativno lako dostupni budući da ih se može izdvojiti iz tjelesnih tekućina, najčešće krvi ali i urina, sline, suza, cerebrospinalne ili amnionske tekućine.
Takav pristup je zadnjih godina naročito popularan i u ekspanziji te se razvilo cijelo područje molekularne dijagnostike temeljene na tekućinskim biopsijama (engl. liquid biopsies). Ovakav pristup dijagnostici je poželjan budući da je minimalno invazivan ili neinvazivan ovisno o kojem tipu tjelesne tekućine se radi. Jasno je da primarni tumor često nije lako dostupan za uzorkovanje no tjelesne tekućine jesu, te je stoga ovaj pristup personaliziranoj dijagnostici i terapiji koja je prilagođena pojedincu na temelju genetskog profila tumora, svakako poželjan. Na temelju ovakvih testova možemo detektirati prisutnost nekog tumora ili metastaza, kao i rane promjene u osoba koje još ne pokazuju simptome neke bolesti. Ako usporedimo molekularne profile osoba oboljelih od neke bolesti s profilom eksosoma zdrave osobe moguće je uočiti razlike u sadržaju eksosoma. Iz te razlike se diferencijalno mogu izdvojiti oni tipovi regulatornih RNA molekula koje bi se mogle koristiti kao dijagnostički biljezi-biomarkeri za određenu bolest.
U novije vrijeme razmatra se i uloga ekstracelularnih vezikula u živčanom sustavu. Prema jednoj zasad ne do kraja utvrđenoj hipotezi moguće je da paraziti poput Trypanosome, koja uzrokuje bolest spavanja, pomoću ovih vezikula na neki način pripremaju teren u svojem domaćinu.3
Interesantna je i potencijalna uloga ovih čestica u prijenosu informacije u živčanom sustavu. Prema nekim ranim istraživanjima pokazano je kako postoje eksosomi koji sudjeluju u komunikaciji neurona tijekom stvaranja pamćenja. S druge strane u neurodegenerativnim bolestima, poput Alzheimera i Parkinsona, dolazi do prijenosa degeneriranog oblika proteina od neurona do neurona te se na taj način „zdravi“ proteini u stanici pretvaraju u nefunkcionalne. Pretpostavka je da bi i u ovaj tip prijenosa u živčanome sustavu mogli biti uključene ekstracelularne vezikule.
Kako se radi o česticama koje su dio nekog organizma, javila se ideja kako bi ih se moglo imitirati te na sličan način u njih upakirati neke agense s terapijskim učinkom koji bi zatim otišli na točno ciljana mjesta u organizmu.
Kako eksosomi znaju kuda moraju ići? Oni na svojoj površinskoj membrani imaju određene molekule koje ih usmjeravaju na točno određene stanice primateljice. Ovakve „prirodne“ a ipak modificirane čestice ne bi bile toksične niti bi ih organizam eliminirao kao strane, te bi ih vjerojatno bolje podnosio zbog njihove manje imunogenosti. Kako se radi o malenim mjehurićima smatra se da bi oni mogli prelaziti barijeru krv-mozak koja je prepreka za značajan broj drugih terapijskih agenasa.
U istraživanju eksosoma još su prisutne poteškoće u njihovoj izolaciji i karakterizaciji. Zasad je najproblematičniji dio u domeni sigurnosti da je čestica koju se izdvojilo uistinu eksosom. U tom svjetlu je i professor Clayton s Odjela za tumore i genetiku Sveučilišta u Cardiffu kada su ga pitali čime se bavi rekao: „Meni se sviđa termin eksosomi jer to je ono što mislim da izučavam, no ne mogu to dokazati.“4
Stoga se danas ubrzano razvijaju različiti pristupi izolacije eksosoma te se traže njihovi specifični biljezi temeljem kojih bismo bili sigurni kako se istražuje prava stvar. Također, u knjizi o eksosomima trenutno je više nenapisanih poglavlja-od njihovog nastanka do njihove uloge u specifičnim fiziološkim i patofiziološkim procesima te će ovo područje istraživanja zasigurno dati još mnogo interesantnih spoznaja, željno očekivanih novih pristupa u terapiji tumora te možda i koju Nobelovu nagradu.
1) Edgar, J.R (2016). Q&A: What are exosomes, exactly?. BMC Biol 14, 46 http://sci-hub.tw/10.1186/s12915-016-0268-z
2) Othman N, Jamal R and Abu N (2019) Cancer-Derived Exosomes as Effectors of Key Inflammation-Related Players. Front. Immunol. 10:2103. doi: 10.3389/fimmu.2019.02103
3) Szempruch AJ i sur.(2016), Extracellular Vesicles from Trypanosoma brucei Mediate Virulence Factor Transfer and Cause Host Anemia2016, Cell 164, 246–257 http://dx.doi.org/10.1016/j.cell.2015.11.051