Nobelova nagrada za fiziologiju ili medicinu
Disanje na razini molekula: ni previše ni premalo kisika nije dobro; kako ga imati baš dovoljno
 Tamara Čačev / 9. listopada 2019. / Članci / čita se 11 minuta
Tamara Čačev / 9. listopada 2019. / Članci / čita se 11 minuta

 Tamara Čačev / 9. listopada 2019. / Članci / čita se 11 minuta
Tamara Čačev / 9. listopada 2019. / Članci / čita se 11 minuta

Istraživanja u području adaptacije na smanjene količine kisika u stanici mogla bi potencijalno rezultirati novim lijekovima za najsmrtonosnije bolesti današnjice kao što su srčani i moždani udar te tumori, piše Tamara Čačev u članku u kojem objašnjava ovogodišnju Nobelovu nagradu za fiziologiju ili medicinu
Ovogodišnja Nobelova nagrada za fiziologiju ili medicinu dodijeljena je znanstvenicima Williamu G. Kaelinu, Jr., Peteru J. Ratcliffeu i Greggu L. Semenza za njihov doprinos u otkrivanju kako stanice osjećaju razinu kisika te kako se na nju prilagođavaju.
Kisik je esencijalna molekula bez koje nema većine života na Zemlji. To je činjenica koju djeca usvajaju vrlo rano tijekom školovanja a sigurno se i nemali broj roditelja još i prije škole namučio da objasni kako i zašto dišemo. Čini se da ne postoji ništa što nam je u fiziologiji bliže od disanja, tako da će vjerojatno mnoge iznenaditi činjenica da se o ovom procesu do nedavno zapravno znalo jako malo.
Svi smo u školi učili o izmjeni plinova u biljkama i životinjama, fotosintezi i disanju. Toliko smo puta to ponavljali kroz osnovnu i srednju školu a neki i na fakultetu da se čini kako se tu i nema puno za dodati. Proučavali su to i učenjaci tijekom proteklih stoljeća. U udžbenicima biologije ti slučajevi služe kao egzamplari klasičnog osmišljavanja znanstvenih pokusa te primjene znanstvenih opažanja. Konačno, za otkrića u području fiziologije disanja već je dodijeljeno i nekoliko Nobelovih nagrada u tridesetim godinama prošlog stoljeća.
Za razliku od onog što u svakodnevnom govoru podrazumijevamo pod disanjem na razini čitavog organizma, kada kisik dolazi na razinu stanice govorimo o tzv. staničnom disanju. Tek ovdje zapravo kisik dolazi na mjesto gdje obavlja svoju funkciju. U osnovi radi se o tome da kisik omogućuje pretvaranje energije iz hranjivih tvari u oblik energije koji stanica može iskoristiti. Dio stanice u kojem se ovi procesi odvijaju su mitohondriji. Za razjašnjavanje nekih elemenata ovog procesa, 1931. godine njemački kemičar Otto Warburg je također dobio Nobelovu nagradu. Warburg se kao kemičar prvenstveno interesirao za kemijske aspekte razmjene energije u živim bićima te kako anorganske molekule prelaze iz svijeta neživog i iskorištavaju se u živim bićima kroz procese staničnog metabolizma i staničnog disanja. Za njegovo opisivanje ključnih enzima i procesa oksidacije i redukcije u stanicama stoga mu je dodijeljena i Nobelova nagrada.

Jedan od njegovih bitnih doprinosa koji je itekako relevantan i aktualan i danas jest i rasvjetljavanje metabolizma tumorskih stanica pri čemu je pokazao kako se one mogu prilagoditi i rasti u uvjetima nedostatka kisika, a čak i u aerobnim uvjetima tumorske stanice preferiraju metabolizam anaerobne glikolize naspram metabolizma koji se odvija uz prisutnost kisika. Taj fenomen je po ovom znanstveniku nazvan i Warburgovim efektom. Izmjenjene metaboličke sposobnosti tumorskih stanica omogućuju im da prežive u drugačijim uvjetima u odnosu na normalne stanice. To im daje komparativnu prednost, no to također može biti i njihov locus minoris resistentiae te se mnoga aktualna istraživanja u području razvoja antitumorskih lijekova upravo usmjeravaju na ove procese.
Korak dalje u izučavanju fizioloških procesa opskrbe kisikom bilo je otkriće karotidnih tjelešaca, kemoreceptora koji služe i kao senzori za razinu kisika u arterijskoj krvi. Ova tjelešca su smještena uz velike krvne žile na vratu te mogu osjetiti pad razine kisika (hipoksiju) i o tome poslati informaciju u mozak koji shodno tome regulira brzinu disanja. Za otkriće ovih senzora 1938. godine Nobelovu nagradu za fiziologiju ili medicinu dobio je belgijski fiziolog Corneille Heymans.

Dakle, regulacija količine kisika u stanicama kroz senzorno-adaptibilne kontrolne sklopke na svim razinama od pojedine stanice do čitavnog organizma je centralni fiziološki proces. No, ovogodišnji su Nobelovi laureati rasvijetlili procese prilagodbe na suboptimalnu razinu kisika, odnosno kako se regulacija kisika odvija na razini molekularnih signalnih puteva kojim se informacija prenosi od „senzora“ kisika ka nekom odredištu koje bi temeljem te informacije moralo pokrenuti druge molekularne procese kojima bi se ponovno uspostavila optimalna razina kisika.
Gregg Semenza se u svojem znanstvenom radu bavio molekularnim mehanizmima pomoću kojih različite razine kisika utječu na ekspresiju gena za eritropoetin (EPO). Pokazao je da neposredno prije samog gena EPO u molekuli DNA postoje specifični regulatorni sljedovi na koje se vežu različite molekule ovisno o količini kisika te na taj način dolazi do diferencijalne ekspresije ovog gena kao odgovor na promjene u razini O2. Peter Ratcliffe također se bavio regulacijom ekspresije gena EPO ovisno o statusu kisika. Obje grupe su na koncu otkrile kako je ovakav mehanizam senzora kisika i adaptacije prisutan u svim stanicama.
Kao što je to slučaj sa gotovo svim otkrićima u znanosti, njihov značaj postaje jasan tek kasnije. Nitko od nas nije mogao predvidjeti dalekosežnost našeg istraživanja kada smo s njime započinjali.
Profesor Semenza je rođen u New Yorku gdje je 1999 postao redovni profesor na Sveučilištu Johns Hopkins te direktor programa vaskularnih istraživanja na Johns Hopkins Institute for Cell Engineering. Profesor Ratcliffe, jedini Europljanin u triu rođen je u Lancashireu u Engleskoj. Studirao je medicinu na Cambridgeu te je zatim na Sveučilištu Oxford osnovao svoj laboratorij.
No, vratimo se natrag samom značaju ovogodišnje nagrade. Kako je rekao i profesor Ratcliffe nakon vijesti o odabiru za nagradu: „Kao što je to slučaj sa gotovo svim otkrićima u znanosti, njihov značaj postaje jasan tek kasnije. Nitko od nas nije mogao predvidjeti dalekosežnost našeg istraživanja kada smo s njime započinjali.”
Zašto nam je dakle bitan baš eritropoetin i procesi koji reguliraju njegovu funkciju? Ovaj hormon dobio je ime po svojoj temeljnoj funkciji a to je da potiče proizvodnju eritrocita (a znamo da su oni glavni prenositelji kisika po našem tijelu), odnosno eritropoezu kao odgovor na hipoksiju. U kulturi stanica jetre Semenza je otkrio proteinski kompleks koji se veže na točno specifičnu sekvencu u molekuli DNA (nazvana HRE) i to u ovisnosti o količini kisika. Ovaj proteinski kompleks nazvao je hypoxia-inducible factor (HIF). Nakon niza godina istraživanja ovaj kompleks je purificiran te je identificiran gen koji ga proizvodi. Kasnije se pokazalo da se HIF sastoji od dvaju transkripcijskih faktora HIF-1α i ARNT.
Kako teče regulacija ekspresije eritropoetina u ovisnosti o razini kisika prikazano je na slici 1. Ukratko, kada je razina kisika visoka, u stanicama je malo molekula HIF-1α. Nasuprot tome, kada je razina kisika niska tada dolazi do porasta HIF-1α. Kada je razina kisika u stanici normalna, HIF-1α se ubikvitinilira te na taj način označi kao target za razgradnju putem proteasoma.
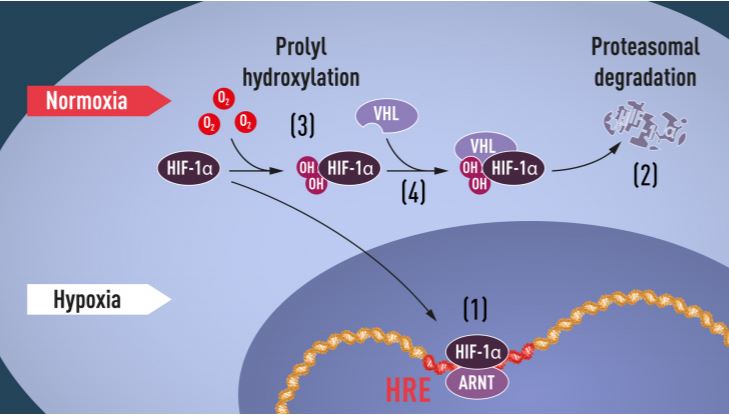
Kako stanica „zna“ regulirati ovaj proces u ovisnosti o razini kisika? Na to je pitanje dao odgovor treći ovogodišnji dobitnik Nobelove nagrade William Kaelin. Fokus njegovih istraživanja bio je jedan naizgled s prethodnim temama nepovezan tumor predisponirajući sindrom čiju je manifestaciju po prvi put opisao njemački oftalmolog Eugen von Hippel početkom dvadesetog stoljeća, dok je švedski patolog Arvid Lindau različite nalaze vezane uz ovaj sindrom ujedinio u jednistvenu bolest koja je nazvana Von Hippel-Lindau sindrom. Radi se o nasljednoj sklonosti stvaranju tumora i cisti na različitim dijelovima tijela. Tumori su uglavnom benigni no mogu maligno alterirati. Kako se radi o nasljednom sindromu, pronađen je i gen čije mutacije uzrokuju ovu bolest. Riječ je o genu VHL, a Kaelin je u svojim istraživanjima pokazao da ovaj gen kodira za protein koji zapravo sprečava nastanak tumora. Ukoliko stanice nemaju funkcionalni VHL gen tada se u njima u velikoj količini eksprimiraju isti geni koji su također jako eksprimirani u uvjetima hipoksije.
S druge pak strane, ukoliko u tumorsku stanicu ubacimo funkcionalni gen VHL tada se uspostavlja njihova normalna razina. Iz ovih pokusa bilo je očito da VHL na neki način sudjeluje u regulaciji odgovora na hipoksiju. Kasnija istraživanja različitih grupa u svijetu su pokazala da je protein VHL sastavni dio kompleksa koji sudjeluje u označavanju proteina ubikvitinom, dakle markerom koji ih šalje na degradaciju. Ratcliffe je povezao ova istraživanja sa svojim te je zajedno sa suradnicima pokazao da je protein VHL u direktnom kontaktu s HIF-1α te da je neophodan za njegovu degradaciju pri normalnim razinama kisika u stanici. Tako je u ovaj puzzle dodao ključnu pločicu koja je nedostajala da se dobije kompletna slika regulacije razine i adaptacije kisika u stanici. Profesor Kaelin započeo karijeru u New Yorku te se uskoro preselio u Boston na Dana-Farber Cancer Institute. Od 2002. godine redovni je profesor na Harvard Medical School.
Koja je šira slika, odnosno zašto je uopće bitno imati detaljne spoznaje o senzorima kisika u organizmu te molekularnim mehanizmima održavanja njegove normalne fiziološke razine? Adaptacija na niske razine kisika jedna je od ključnih evolucijskih prilagodbi. Kada vježbate ili boravite na višim nadmorskim visinama mijenjaju se uvjeti opskrbljenosti kisikom. Jasno je da je kod sportskih aktivnosti i općenito fizičkog napora bitna adekvatna opskrba mišićnih stanica dovoljnom količinom kisika za njihov pojačani rad. S druge strane, na višim nadmorskim visinama, razina kisika u zraku je drugačija u odnosu na nizinu te je potrebno pojačati dotok kisika do tkiva i stanice. Dakle, mora postojati senzor koji će osjetiti te promjene u razini kisika i adekvatno tome reagirati pokretanjem različitih signalnih puteva i ekspresije gena koji će nastojati vratiti opskrbu kisikom na ravnotežnu razinu koja je potrebna za pravilnu fiziološku funkciju. Stoga možemo čuti kako sportaši idu na tzv. visinske pripreme čime se u biti okidaju isti adaptacijski mehanizmi kao i kod povećanih potreba za kisikom tijekom intenzivnog vježbanja. Opskrba kisikom bitna je i tijekom fetalnog razvoja djeteta te je također esencijalno precizno reguliranje razine kisika kao i pravilno funkcioniranje placente. Ukoliko kisika nema dovoljno, jedan od mehanizama koji se aktivira kao adaptacija na novonastale uvjete jest i razvoj novih krvnih žila kojima se nastoji poboljšati dotok kisika do samih stanica.
Osim u prije spomenutim normalnim fiziološkim stanjima, poremećaji u opskrbi kisikom mogu rezultirati nastajanjem niza akutnih stanja poput inzulta ili infarkta s dugoročnim posljedicama odumiranja ciljnih stanica koje su ostale bez kisika te trajnim oštećenjima mozga i srca. U patofiziološkom smislu posebno je i dosta intenzivno istraživana i hipoksija u kontekstu tumora. Tumorske stanice su razvile mehanizme koji im daju komparativnu prednost u odnosu na normalne tjelesne stanice. No, za rast tumora iznad 1-2 mm3 potrebno je osigurati njihovu adekvatnu opskrbu kisikom i hranjivim tvarima budući da je to limitirajuća veličina iznad koje njihova difuzija nije dostatna. To je moguće ostvariti kroz nastanak novih krvnih žila-neoangiogenezu. Upravo je jedan od prvih revolucionarnih ciljanih antitumorskih lijekova bilo antitijelo na VEGF, faktor koji je ključan regulator angiogeneze. Stoga ne čudi kako je područje istraživanja hipoksije i neoangiogeneze u kontekstu tumora hot topic te velike farmaceutske kompanije imaju posebne smjerove istraživanja uperene na ove procese.
Iz svega prije navedenog jasno je da je regulacija opskrbe kisika jedan od ključnih fizioloških procesa kako u zdravlju tako i u bolesti te je doprinos razjašnjavanju mozaika ovih procesa od velikog značaja te sa širokim rasponom utjecaja na niz područja u biomedicini.
Ključne publikacije u kojima su objavljena otkrića nagrađena Nobelovom nagradom za medicinu ili fiziologiju 2019:
1) Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
2) Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514
3) Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
4) Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468 Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-a to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472