MOLEKULARNA BIOLOGIJA
Genske terapije. Nada za oboljele i tržište u usponu. Tko će plaćati milijune po pacijentu?
 Tamara Čačev / 12. srpnja 2023. / Članci / čita se 12 minuta
Tamara Čačev / 12. srpnja 2023. / Članci / čita se 12 minuta
 Tamara Čačev / 12. srpnja 2023. / Članci / čita se 12 minuta
Tamara Čačev / 12. srpnja 2023. / Članci / čita se 12 minuta

Genske terapije omogućavaju oboljelima od niza bolesti koje u podlozi imaju mutaciju nekog gena potencijalno jednokratno rješenje za njihove muke. Visoka cijena ovih terapija - koja doseže milijune dolara po pacijentu - mogla bi se opravdati činjenicom da su one u mnogim slučajevima jeftinije od cjeloživotnog troška oboljelog po zdravstveni sustav. Tamara Čačev u svojem tekstu ističe kako je u Hrvatskoj moguće već dobiti neke od ovih modernih terapija, no one su velik zalogaj i za puno bogatija društva.
Ovih je dana američka Agencija za hranu i lijekova (FDA) odobrila još jednu u nizu genskih terapija, ovaj put za Duchennovu mišićnu distrofiju. Riječ je o nasljednoj bolesti koja progresivno vodi do slabljenja i propadanja svih mišića u tijelu, za koju nije bilo lijeka do terapije oligonukleotidima, primjenjive samo na dio oboljelih, te do ovog pokušaja genske terapije. Kažem pokušaja, jer je FDA odobrila ovu terapiju nakon dugog odgađanja i s vrlo ograničenim indikacijama. Radi se o djeci između četiri i pet godina, jer se smatra da je u toj dobnoj skupini ova terapija u kliničkim ispitivanjima dala najbolje rezultate. Oni se svakako moraju potvrditi daljnjim istraživanjima kako bi se do kraja verificirao njen pozitivni učinak.
No, zašto je to onda vijest koju su popratili i znanstveni (časopis Nature) i drugi mediji? Iako već dugi niz godina postoje načini kako se mutacija može detektirati tijekom prenatalnog testiranja u obiteljima gdje je ova nasljedna bolest prisutna, zbog mehanizma nastanka ove bolesti farmaceutska industrija do danas nije mogla ponuditi adekvatnu terapiju koja bi, ako već ne zaustavila bolest, onda barem usporila njenu progresiju. Bolest uzrokuje varijanta gena za distrofin koja smanjuje njegovu količinu u mišićima, a kako se radi o genu koji se nalazi na X kromosomu češće od nje obolijevaju muška djeca. Ta varijanta gena dovodi do slabljenja mišića koje se može javiti već u dobi od dvije godine, a zatim se progresivno gubi sposobnost pokretanja mišića što u konačnici dovodi do gubitka sposobnosti hodanja i samostalnog disanja. U terapijskom smislu postoje pristupi koji mogu donekle i na neko vrijeme ublažiti simptome, no nažalost životni vijek oboljelih je kratak te u prosjeku dožive 20-30 godina života.
Prije nekoliko godina ostvaren je prvi značajniji pomak u terapiji ove bolesti primjenom antisense oligonukleotida, još jednim od uspjeha molekularne biologije u otvaranju novih mogućnosti za terapiju niza bolesti. Ovaj pristup temelji se na terapiji sekvencom DNA koja osigurava da se u stanici neutraliziraju produkti mutiranog gena te da se „preskoči“ dio koji je mutiran. Time nastaje protein koji je kraći od “normalnog” ali još uvijek ima dio funkcionalnosti. Tako su razvijene terapije za mutacije u eksonu 45 (casimersen), 51 (eteplirsen), 53 (viltolarsen, golodirsen) gena za distrofin. No, ovo nisu lijekovi koji će izliječiti osobu od ove bolesti već će olakšati njene simptome i to samo kod onih oboljelih kod kojih je potvrđena mutacija u nekom od ovih eksona. Procjenjuje se da svega 13% oboljelih ima mutaciju u eksonu 51 te oko 8% njih u eksonu 53 te ih to čini pogodnim kandidatima za ovu vrstu terapije. Terapije su odobrene po ubrzanom postupku FDA te se konačni stav o njihovoj učinkovitosti tek treba zauzeti.
Novoodobrena genska terapija Elevidys, tvrtke Sarepta Therapeutics, temelji se na genijalnom rješenju kojim se zaobišao problem veličine gena distrofina, jednog od najvećih gena čovjeka, što je bila ogromna prepreka za stvaranje genske terapije. U novoj terapiji u oboljelih se njihova varijanta gena u stanicama zamjenjuje modificiranom verzijom gena koji izaziva blažu kliničku sliku (Beckerovu mišićnu distrofiju). Radi se o verziji gena koja je oboljelom od Beckerove mišićne distrofije, iz čije je DNA definirana sekvenca s kojom se počeo raditi genski konstrukt, omogućila da ostane pokretan i funkcionalan sve do 60-tih godina života. U genetičkom smislu, verzija gena koju je ovaj oboljeli imao bila je znatno kraća od ispravnog gena te je stoga i pogodnija za gensku terapiju. Dakle radi se o zasad najkraćoj mogućoj verziji gena koja omogućava njegovu adekvatnu funkcionalnost što omogućuje da se takva kraća sekvenca ipak lakše koristi u genskoj terapiji.
No čak i ta puno kraća verzija gena za distrofin mora dospjeti u što više stanica mišića oboljelog kako bi se postignuo željeni učinak. Tu dolazimo do još jedne od značajnijih prepreka razvoju genske terapije a to je njena isporuka u stanice. Može se reći kako se rješavanjem ovog krucijalnog problema genske terapije radi od samog početka. Jer nefunkcionalni gen treba zamijeniti ili neutralizirati idealno u svim stanicama organizma, ili barem u onima gdje je to najbitnije a na tom ispitu su do nedavno padali svi pokušaji genske terapije. U slučaju Duchennove mišićne distrofije treba kako i samo ime govori djelovati u mišićnom tkivu. Donekle je to bolja situacija nego da se mora djelovati na sve stanice organizma, no i ovo je popriličan pothvat.
Terapija Elevidys koristi kao vektor (sredstvo unosa gena u stanicu) virus prehlade, jer se zna da on može zaraziti mišićne stanice. Ovaj je virus dodatno modificiran tako da preferencijalno djeluje upravo u njima. Tijekom 2018. godine ovom terapijom tretirana su četiri dječaka u dobi od 4 do 7 godina i do današnjeg dana (5 godina) oni nisu pokazali progresiju bolesti što je svakako enorman uspjeh za znanost i neizmjerna sreća za njihove roditelje. No, u studiji koja je uslijedila i obuhvatila veći broj oboljelih od kojih su neki bili i u uznapredovalim stadijima bolesti, rezultati nisu bili tako jasni te je stoga na kraju i definiran vrlo uski set indikacija.
Trebalo bi se raditi o jednokratnoj terapiji koja bi djelovala doživotno, no to tek treba vidjeti
Kada ste u zadnje vrijeme slušali o humanitarnim akcijama koje se pokreću za liječenje oboljele djece, gotovo u svim slučajevima se radilo o varijantama genske terapije. Tako će vjerojatno biti i s ovom sve dok nije odobrena na nacionalnoj razini. Kako trenutno izgleda, trebalo bi se raditi o jednokratnoj terapiji koja bi djelovala doživotno, no naravno, to tek treba vidjeti. Cijena u SAD je 3.2 milijuna dolara, a proizvođač navodi da je to na kraju još uvijek manji trošak za zdravstvo u odnosu na cjeloživotnu skrb koju trenutno plaćaju za oboljele.
Ranije ove godine, nakon odobrenja u kolovozu 2022., po prvi je put administrirana i genska terapija za beta-talasemiju Zynteglo, tvrtke Bluebird bio. Radi se o nasljednoj bolesti koja utječe na funkcionalnost hemoglobina i rezultira anemijom te zahtijeva u težim slučajevima i doživotne odlaske na transfuziju i druge komplikacije. Ova je bolest, kao i srpasta anemija, posebno stigmatizirajuća za afroameričku populaciju jer se na mjesečno izostajanje s posla zbog posljedica ove bolesti nije gledalo baš blagonaklono. I ovdje se radi o terapiji od 2.8 milijuna dolara, no u različitim fazama pred odobrenje su genske terapije drugih proizvođača pa se očekuje i korekcija ove cijene. Zanimljivo je da je ova terapija prethodno već bila odobrena u EU, no bilo je problema s plaćanjem na račun zdravstvenih osiguranja te je ova tvrtka prekinula daljnje djelovanje u Europi.
Uz ove dvije terapije, FDA je prethodno odobrila još svega nekoliko genskih terapija za nasljedne bolesti – za jedan oblik sljepoće, nasljedne distrofije mrežnice koji se javlja u djetinjstvu povezane s mutacijom gena RPE65 (terapija je dostupna i u HR), hemofiliju tipa B, cerebralnu adrenoleukodistrofiju (prikazana u filmu Lorenzovo ulje) te za spinalnu mišićnu atrofiju (Zolgensma, Novartis) o kojoj se u medijima govorilo i kod nas vezano uz humanitarne akcije a danas su već i u Hrvatskoj dostupne terapije i drugih proizvođača za ovu bolest. Sva ova odobrenja izdana su tijekom prethodnih nekoliko godina, a prema prijavama za odobrenje jasno je da se nakon 50 godina sna o genskoj terapiji on konačno i počeo ostvarivati (Tablica 1). Farmaceutski giganti poput Novartisa, Rocha i Bayera pokupovali su male biotehnološke start-upove po cijenama od oko milijardu dolara i uhvatili korak. Taj tip akvizicija sve je češći u odnosu na in house istraživanje i razvoj jer se pokazalo da nažalost nije samo dovoljno investirati u institute, opremu i ljude već treba imati i pravu ideju i puno sreće. Očekuje se da će se te investicije isplatiti jer će tržište u 2027 dosegnuti 20 milijardi dolara prihoda.
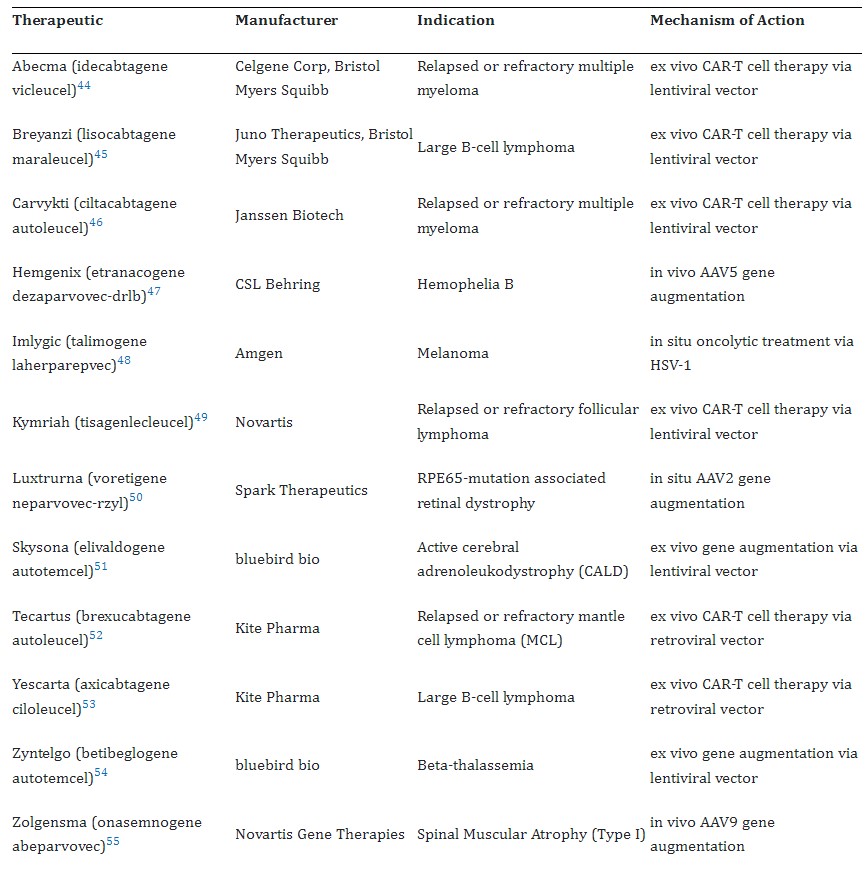
Za 2024. godinu predviđa se izlazak na tržište 21 stanične i 31 genske terapije uglavnom temeljene na adenoviralnim vektorima. Stoga bi 2023/2024 mogli označiti kao povijesnim prekretnicama u ovom području budući da je u ovom periodu odobrena prva CRISPR terapija, terapija alogenim T stanicama te najviše genskih terapija do sada.
No, put do toga bio je trnovit. Sada već daleke 1972. zasijana je ideja genske terapije kao metode liječenja bolesti čovjeka (Friedmann i Roblin) no trebalo je gotovo 30 godina da se ona dovede do kliničkih ispitivanja te još 25 godina da se odobri prva genska terapija u SAD. Početkom 90-tih provedena je prva klinička studija u kojoj je korištena genska terapija. Radilo se o izdvajanju limfocita iz tumorske mase metastatskog melanoma koji su zatim modificirani tako da dobiju rezistenciju na neomicin te su vraćeni u oboljele koji su zatim dalje tretirani terapijom. Ovaj je pokušaj bio relativno uspješan, no tijekom 2000-tih došlo je do nekoliko „incidenata“ sa smrtnim ishodom ili naknadnim razvojem leukemija tijekom testiranja različitih genskih terapija i to dovelo do zastoja u daljnjem razvoju ovog područja.
U metodološkom smislu postoji nekoliko osnovnih pristupa razvoju genske terapije ovisno o genskom defektu koji je potrebno ispraviti ili kompenzirati. Genska terapija zapravo predstavlja prijenos genetskog materijala u stanice s ciljem da se modificira njihova funkcija u smjeru terapije bolesti koju genski defekt izaziva. To znači da možemo mutiranu verziju gena koja izaziva bolest zamijeniti zdravom kopijom, zatim možemo inaktivirati gen koji ne funkcionira adekvatno ili možemo u stanice ubaciti novi gen kojim ćemo kompenzirati deficijenciju koju je genetski defekt izazvao. Ako genetska promjena izaziva preveliku ili neprimjerenu ekspresiju gena možemo ga suprimirati bilo inhibitorima bilo RNA interferencijom (slučaj antisense oligonukleotida). Konačno, u novije vrijeme možemo gen doslovno izrezati iz DNA, editirati uz pomoć CRISPR-Cas tehnologije.
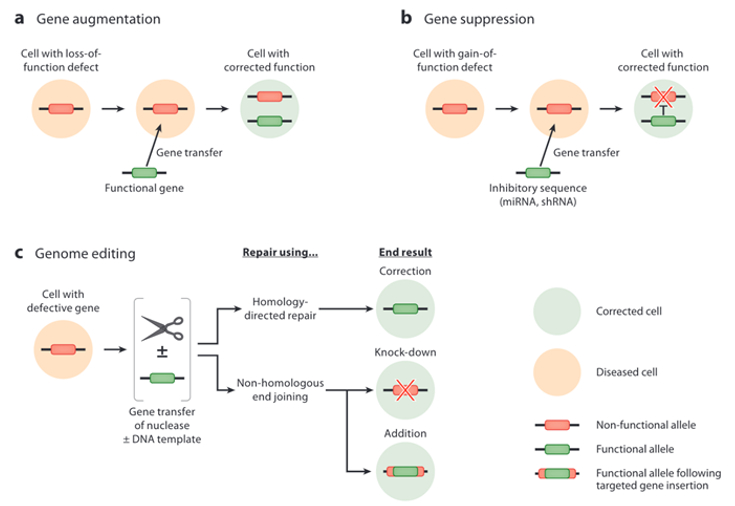
Administriranje same terapije može biti in vivo, ex vivo i in situ. In vivo znači da se terapija daje direktno oboljelom najčešće sistemski u krvotok. In situ se odnosi na davanje genske terapije direktno u ciljno tkivo poput oka. Bolesti krvnih stanica mogu se tretirati i ex vivo na način da se ciljne krvne stanice izdvoje iz organizma, genetski izmijene i vrate natrag u oboljelog. Ponekad se terapije koje se temelje na modificiranju stanica ex vivo nazivaju i cell therapies a ujedinjeno s genskom terapijom cell and gene therapies odnosno kraticom CGT. Iako se i mRNA cjepiva unose putem vektora (lipidnih nanočestica) to se ne može smatrati genskom terapijom budući da se genetski materijal stanice ne mijenja te unos mRNA nije ciljan na točno određena tkiva gdje bi se imala odraditi nekakva kompenzacija genskog defekta već se radi o korištenju mehanizacije stanice za sintezu proteina na koji će reagirati stanice našeg imunološkog sustava.
Isporuka genetskog materijala na mjesto gdje mora obavljati svoju funkciju je jedna od ključnih prepreka u razvoju uspješne genske terapije. Vektori, sredstva putem kojih se genska terapija unosi u stanice bitni su kako za isporuku u prave stanice kao i za kapacitet tj. veličinu genskog zapisa koji se unosi te također i potencijalnu imunološku reakciju na vektor. Najčešće se u tu svrhu koriste virusi.
Smatra se kako će primjena AI pogotovo u modeliranju proteina i međumolekularnih interakcija ubrzati sve segmente farmaceutske industrije, no i tu valja biti oprezan u optimizmu jer primjena AI ovisi o eksperimentalnim podacima a njihovo stvaranje je skupo i još uvijek ovisno o ljudskom radu te tako i dalje predstavlja usko grlo cijelog procesa. S druge pak strane, primjena AI može poboljšati predselekciju eksperimenata koje vrijedi odraditi. Idealno bi bilo paralelno raditi na obje fronte, no ekspertiza potrebna u tzv. wet labu (eksperimentalni dio istraživanja) i za in silico analize (AI) je različita i ne radi se o istim timovima ljudi niti o istim znanstvenim pozadinama te je za dijalog i razumijevanje oba segmenta potrebno najprije naučiti „govoriti“ istim jezikom.
Može li ijedno zdravstveno osiguranje pojedinca pokriti tako rijedak a opet ogroman trošak?
Kako se radi o skupoj i izrazito kompleksnoj pripremi, administriranju terapije i oboljelog, a s druge strane o rijetkosti potrebe za njom to stvara čitav niz poteškoća kako oboljelima tako i zdravstvenim i osiguravajućim sustavima. Postavlja se pitanje može li ijedno zdravstveno osiguranje pojedinca pokriti tako rijedak a opet ogroman trošak. Rješenje se vidi u formiranju fondova za skupe lijekove i terapije, no nisu sve države jednakog gledišta na ovu vrstu troškova iako se smatra da bi se u značajnom broju slučajeva moglo raditi samo o jednokratnom tretmanu čija cijena bi ipak bila manja od doživotne zdravstvene skrbi za oboljelog.
Eksperimentira se i s novim modelima refundacije tako velikih iznosa koji se temelje na ishodu liječenja. Ideja je da osiguravatelj plati dio cijene prije administriranja terapije a ostatak nakon što se postignu specifični ishodi liječenja. Drugi model uključuje plaćanje punog iznosa unaprijed no ukoliko terapija ne postigne učinak tada se dio sredstava vraća. I konačno, terapija se plaća u godišnjim ratama sve dok se postižu unaprijed definirani ishodi. Naravno, postoji i ideja da bi proizvođači naprosto trebali sniziti cijenu, pristup koji je primijenila Njemačka na spomenutu Bluebirdovu terapiju što je rezultiralo povlačenjem s EU tržišta.
Iznosi koje treba izdvojiti za genske terapije je naravno teško zamisliv prosječnoj osobi, no treba znati da nam naš zdravstveni sustav već danas u Hrvatskoj omogućava izrazito skupe milijunske terapije uz poštivanje indikacija. Ipak, ovo je velik zalogaj i za puno bogatija društva te tek treba vidjeti hoće li boom genske terapije za čiji razvoj su također potrebna velika sredstva pratiti i omasovljavanje (jer oboljelih ima koliko ima, a to i nije velik broj) te pojeftinjenje kako to obično biva sa svakim tehnološkim napretkom.
Lueptow LM , Tawil B. Breakthroughs in gene therapy: technological progress, current treatments, and future potential. J Appl Biotechnol Bioeng. 2023;10(1):37‒43
Pagliarulo N. 5 questions facing gene therapy in 2023. https://www.biopharmadive.com/news/gene-therapy-editing-trends-outlook-2023/640234/
Conroy G. How viruses are driving the gene-therapy renaissance. Nature. 2022; 612: S24
Reardon S‘It’s a vote for hope’: first gene therapy for muscular dystrophy nears approval, but will it work? Nature https://www.nature.com/articles/d41586-023-01799-z