biologija
Inzulinska rezistencija, uglavnom se ne dijagnosticira, a izaziva niz opasnih bolesti. Uloga gena
 Tamara Čačev / 25. kolovoza 2022. / Članci / čita se 15 minuta
Tamara Čačev / 25. kolovoza 2022. / Članci / čita se 15 minuta

 Tamara Čačev / 25. kolovoza 2022. / Članci / čita se 15 minuta
Tamara Čačev / 25. kolovoza 2022. / Članci / čita se 15 minuta

Cijeli niz procesa u vezi s djelovanjem inzulina na molekularnoj razini nije razjašnjen pa se na njih ne može ni utjecati, piše Tamara Čačev, ali se iz iskustva zna da na inzulinsku rezistenciju utječu tip prehrane i životni stil. Sjedilački način života i pretilost najzirazitiji su znaci opasnosti
Inzulinska rezistencija sve se više spominje u medijima u različitim kontekstima, od prevencije kroničnih bolesti do fitness portala, no značenje tog pojma se, kako to obično biva, tek podrazumijeva, iako zapravo rijetko tko može ispravno opisati o kakvom se poremećaju radi. U obranu svih koji su se dotakli ove teme a nisu endokrinolozi, uključujući i mene, radi se o vrlo kompleksnoj problematici čiji molekularni aspekti nisu ni danas do kraja razjašnjeni. Istovremeno se radi o nečemu što zahvaća puno više ljudi te započinje u puno ranijim fazama života nego što se prije mislilo. Ujedno je i temelj mnogih bolesti modernog sjedilačkog načina života od kardiovaskularnih bolesti, bolesti jetre i dijabetesa čak i do tumora. U duhu ideje da su ljudi bolje prijemčivi za promjene životnog stila ako razumiju mehanizme kojima svojim odabirom utječu na vlastiti organizam, odlučila sam se ipak uhvatiti ukoštac s ovom kompleksnom temom.
Kao biolog, krenut ću od šireg evolucijskog konteksta. Čovjek je možda jedina vrsta (osim kućnih ljubimaca i domaćih životinja koje su o njemu ovisne) koja danas, barem u razvijenim dijelovima svijeta, živi u energetskom izobilju. Svakodnevno imamo na raspolaganju i unosimo više hrane nego što je metabolički potrebno, dok obaveze zahtijevaju sve manje tjelesnog angažmana ako si ga sami svjesno ne nametnemo. No, takve životne prilike su relativno recentne u evoluciji čovjeka. Sve donedavno izvori hrane bili su rijetki, nesigurni i nepredvidivi, kao što je i danas za sve ostale životinje, pa je naš ‘stroj’ još uvijek podešen na takav režim rada. Većinu svoje povijesti ovisili smo o tome što ćemo uloviti i sakupiti iz prirode koja nas okružuje. U takvim uvjetima organizam mora biti štedljiv i na najefikasniji način koristiti dostupnu energiju a potencijalni višak spremiti za naknadno korištenje. Uvijek me takva razmišljanja odvedu do toga koliko smo danas zapravo disocirani od vlastitog staništa te da nas netko ostavi da uistinu moramo samostalno doći do hrane to vjerojatno ne bi dobro završilo. Već ova pomisao tjera me da se zaputim prema hladnjaku i sasvim bespotrebno nešto pojedem, za svaki slučaj.
Prilike su se za čovjeka promijenile, bolja prehrana svakako je imala ulogu u produženom životnom vijeku, no razvojem prehrambene industrije i pojavom visokoprocesirane hrane nabijene kalorijama pokazuje se istinitost anglosaksonske uzrečice too much of a good thing. Metabolički mehanizmi nisu podešeni na uvjete izobilja i smanjene kalorijske potrošnje i to je uzrok većine kroničnih bolesti suvremenog čovjeka. Zbog toga danas imamo pandemiju pretilosti te pratećih bolesti poput nealkoholne masne bolesti jetre, ateroskleroze i šećerne bolesti tipa 2. Radi se o kliničkim manifestacijama nakon desetljeća neadekvatnog funkcioniranja organizma na razini stanica, a u korijenu je inzulinska rezistencija. Iako neće sve pretile osobe razviti dijabetes tipa 2, pretilost je glavni čimbenik rizika za njegov nastanak: prema nekim istraživanjima učestalost predijabetesa (stanja koje prethodi dijabetesu) i dijabetesa u SAD-u je veća od 50%.1
Koja je uloga inzulina u zdravom organizmu i zašto su poremećaji u njegovoj funkciji za nas tako bitni? Inzulin je hormon koji se veže na receptore ciljnih stanica kako bi aktivirao procese koji rezultiraju unosom glukoze u stanicu. Iako gotovo sve stanice u organizmu imaju te receptore, glavnu ulogu u regulaciji razine glukoze u organizmu imaju stanice skeletnog mišićja, jetre te tzv. bijelog masnog tkiva. U organizmu u kojem metabolički procesi ispravno funkcioniraju, razina glukoze u krvi se održava u fiziološki normalnom rasponu pomoću fiziološki normalne količine inzulina.
Tijekom posta, tijekom noći dok spavamo, glukoza potrebna za rad stanica otpušta se iz zaliha u jetri kroz procese razgradnje glikogena i kroz metaboličke procese stvaranja glukoze iz drugih metaboličkih izvora. Istovremeno se iz masnih stanica otpuštaju slobodne masne kiseline i glicerol koji služe kao pogonsko gorivo za mišiće i srce te kao izvor energije i komponenti potrebnih za sintezu glukoze u jetri. Nakon obroka razgradnjom tvari unesenih hranom raste razina glukoze u krvi i kao odgovor na taj poticaj beta-stanice gušterače izlučuju inzulin kako bi održale njenu optimalnu, ni prenisku ni previsoku, razinu u krvi. Ovu ravnotežu omogućava činjenica da su tkiva osjetljiva na djelovanje inzulina. Pod njegovim utjecajem unose glukozu u stanice i što je osjetljivost stanica veća potrebne su manje količine inzulina za normalizaciju razine glukoze u krvi.
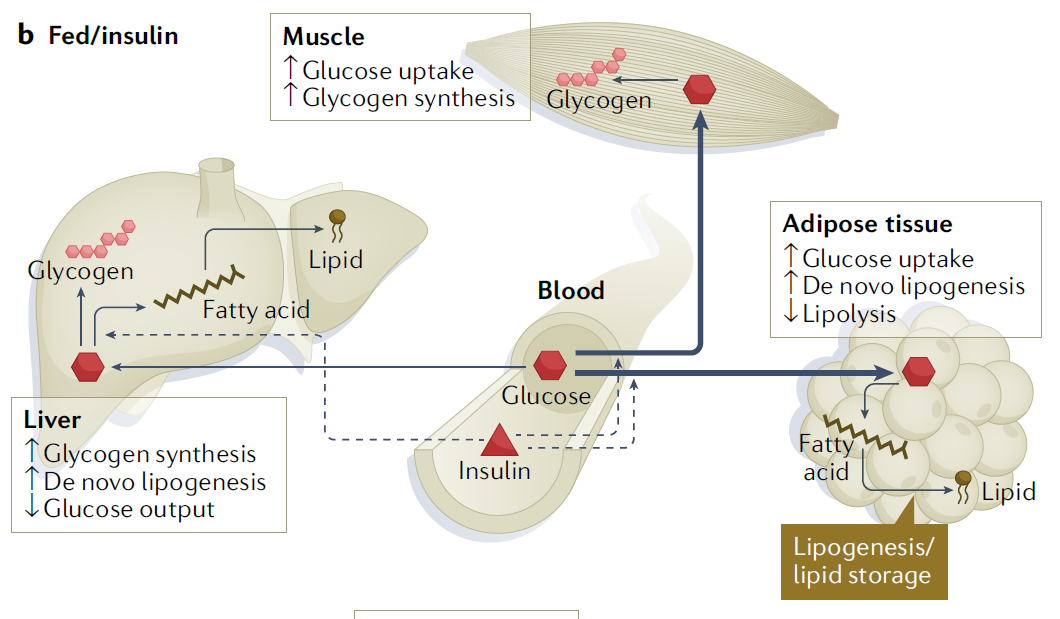
Osim preuzimanja glukoze unesene obrokom u mišiće za neposredni rad i masno tkivo za rezervu energije, inzulin zaustavlja proizvodnju glukoze iz zaliha koje organizam ima u jetri u obliku polimera glikogena kao i otpuštanje slobodnih masnih kiselina odnosno razgradnju masti (lipolizu) u stanicama masnog tkiva. Većina glukoze nakon obroka se deponira u mišićima kao glikogen dok se tek manja količina pohranjuje u masnim stanicama gdje se sintetiziraju trigliceridi kao dugotrajniji oblik rezervi energije (slika 1).
Kada je za održavanje normalne razine glukoze potrebno lučenje viših razina inzulina kako bi se postigao isti učinak normalizacije količine glukoze u krvi tada je kod osobe prisutna inzulinska rezistencija. Organizam uspijeva osigurati normalnu razinu glukoze ali uz puno više razine inzulina jer su stanice u koje bi se ulaz glukoze trebao omogućiti postale na njega rezistentne. To u konačnici znači da osobe s inzulinskom rezistencijom imaju povišene razine inzulina u krvi i to se stanje naziva hiperinzulinemijom. U ovoj fazi imamo normalne razine glukoze uz povišenu razinu inzulina u plazmi na tašte. Ovakav nalaz je karakterističan za predijabetes, lipodistrofiju, sindrom policističnih jajnika te nealkoholnu masnu bolest jetre.
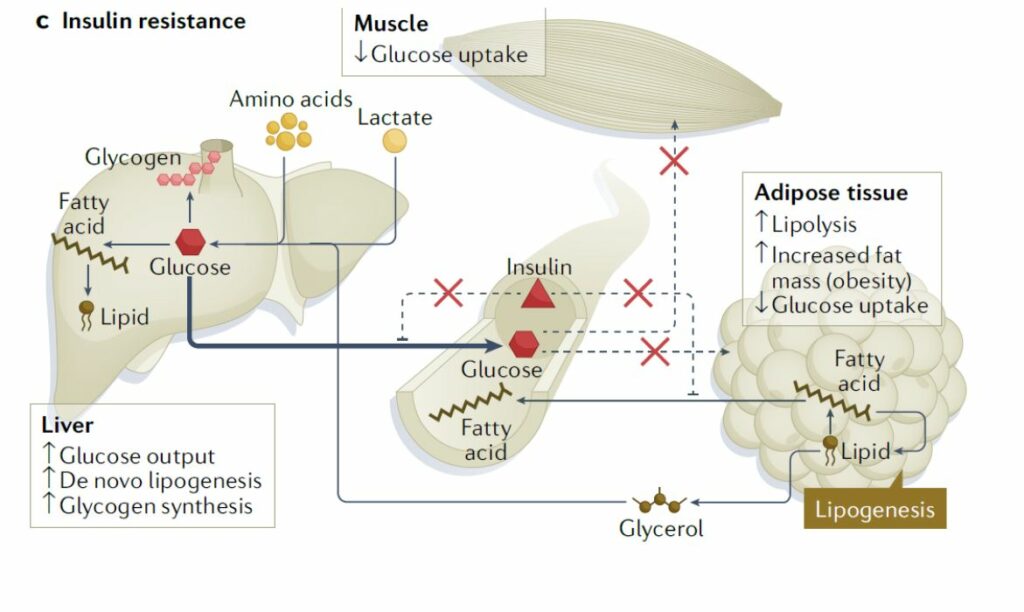
Kod pretilih osoba kao i osoba s dijabetesom tipa 2 ovi mehanizmi inzulinom reguliranog ulaza glukoze u mišićne stanice i stanice masnog tkiva, kao i supresija proizvodnje dodatne glukoze u jetri, poremećeni su i to se stanje naziva inzulinskom rezistencijom. Istovremeno dolazi do povećane proizvodnje glukoze u jetri kao i do povišenih razina slobodnih masnih kiselina u krvotoku jer su stanice u koje nije ušla glukoza i dalje ‘gladne’ i šalju signale kojima nastoje namaknuti glukozu. Takvo stanje može trajati neko vrijeme pri čemu će osoba i dalje uspijevati imati normalne razine glukoze u krvi no gušterača se iscrpljuje i ne može više kompenzirati rezistenciju ciljnih stanica na inzulin proizvodnjom sve više i više inzulina. Kada se ovakvi poremećaji više ne mogu kompenzirati dolazi do povišenja razine glukoze u krvi (hiperglikemije) na tašte što je karakteristika dijabetesa tipa 2 (Slika 2).
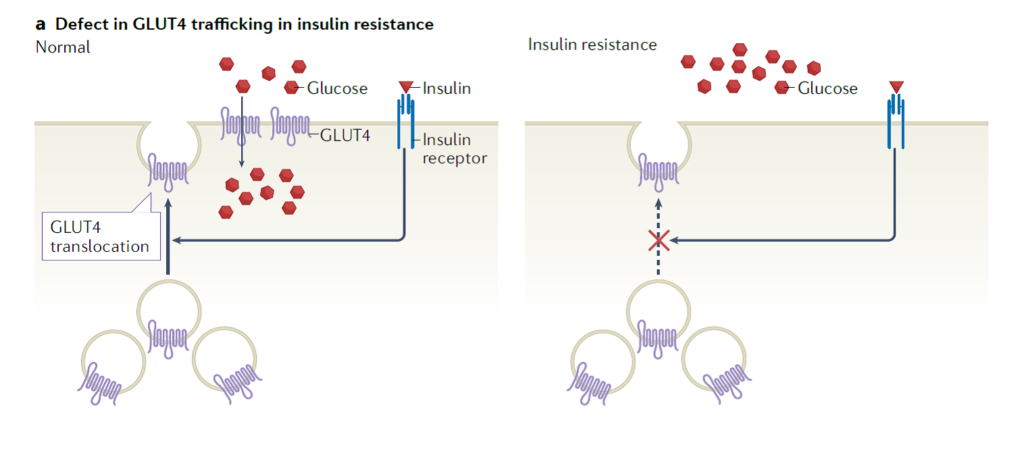
Ovi fiziološki mehanizmi opaženi su relativno rano u razvoju moderne medicine, no promjene u stanicama na razini molekula te signalni putevi koji reguliraju ova događanja u stanicama počeli su se razjašnjavati relativno nedavno i stoga slika djelovanja inzulina na signalizaciju na subcelularnoj razini nije još ni približno jasna. Na molekularnoj razini inzulinsku rezistenciju karakterizira nemogućnost inzulina da aktivira unos glukoze u stanice mišića i masnog tkiva. Preciznije, ne uspijeva se aktivirati transportni sustav za glukozu u stanici koji se naziva GLUT4 sistem za transport glukoze za koji je dokazano da postoji u skeletnom mišićju, srcu, masnim stanicama te neuronima koji su senzitivni na inzulin. GLUT4 je pohranjen u vezikulama u stanici te kada je stanica stimulirana inzulinom, odlazi na membranu i sudjeluje u transportu glukoze (Slika 3). Zanimljivo je da i vježbanje stimulira premještanje GLUT4 na membranu mišićnih stanica i da u tome ne sudjeluje inzulin te iz toga proizlazi kako se dio učinka inzulinske rezistencije barem dijelom može anulirati tjelesnom aktivnosti.
Inzulinska rezistencija se danas smatra rizičnim čimbenikom za razvoj niza metaboličkih bolesti uključujući dijabetes tipa 2, kardiovaskularne bolesti te nealkoholne bolesti jetre. U novije vrijeme postoje naznake kako je inzulinska rezistencija povezana i s progresijom nekih tipova tumora kao i neurodegenerativnih bolesti. Sada kada smo ukazali važnost inzulinske rezistencije u etiopatologiji mnogih bolesti suvremenog čovjeka, nažalost treba dodati kako se ona uglavnom ne dijagnosticira. Glavni razlog tome je to što osobe s inzulinskom rezistencijom ne pokazuju aberantne razine glukoze u krvi već bi se trebala određivati razina inzulina što nije rutinska praksa. Dodatno, ne razvijaju sve osobe s inzulinskom rezistencijom dijabetes tipa 2 i danas se smatra kako tome mora prethoditi i neka dodatna predispozicija za deficijenciju beta-stanica gušterače. No, i da ne razviju dijabetes tipa 2, osobe s inzulinskom rezistencijom mogu biti podložne bolestima koje su s njim povezane kao što su retinopatije, neuropatije i bolesti bubrega.
Većina osoba s inzulinskom rezistencijom također je pretila iako nije jasno je li je pretilost posljedica povišenog inzulina ili je povišen inzulin posljedica pretilosti
Većina osoba s inzulinskom rezistencijom također je pretila iako nije jasno je li je pretilost posljedica povišenog inzulina ili je povišen inzulin posljedica pretilosti. Ova tri obilježja često koegzistiraju u svojevrsnom trokutu interakcije. Tako je jasno da prekomjerni unos kalorija dovodi do pretilosti i hiperinzulinemije kao i inzulinske rezistencije, no pokazano je i da kronična izloženost inzulinu izaziva inzulinsku rezistenciju i debljinu. Genetičke karakteristike osobe ili farmakološke intervencije koje izazivaju inzulinsku rezistenciju pak vode u hiperinzulinemiju. Nije postignut niti konsenzus oko toga da li ove promjene počinju najprije u mišićima pa zatim u jetri i masnom tkivu ili se događaju istovremeno i sistemski na razini čitavog organizma.
U mišićnom tkivu inzulin potiče ulazak glukoze u stanice te njeno skladištenje u polimernom obliku glikogena. U jetri se pod utjecajem inzulina također aktivira sinteza glikogena ali i ekspresija gena koji sudjeluju u stvaranju masti dok se istovremeno smanjuje proizvodnja glukoze procesom glukoneogeneze tj. stvaranja glukoze iz drugih tipova makromolekula u organizmu budući da za time više nema potrebe jer je glukoza ušla u stanicu. U bijelom masnom tkivu inzulin suprimira razgradnju postojećih masti te potiče ulaz glukoze te sintezu novih masti.
Ovi direktni učinci inzulina ostvaruju se putem vezanja inzulina na inzulinski receptor na površini stanice. Radi se o proteinu tetrameru koji ima tirozin kinaznu aktivnost. Kinazna aktivnost znači da protein ima sposobnost fosforilacije proteina s kojima stupa u interakciju te ih na taj način aktivira. Ovaj tip aktivacije karakterističan je za kaskadni prijenos signala s receptora na površini stanice ka nekom od proteina u samoj stanici koji će nakon primljenog signala i aktivacije odraditi neku zadaću u stanici.
Ugrubo se nizvodni signalni događaji koji nastaju kao posljedica aktivacije inzulinskog receptora mogu podijeliti na mitogene i metaboličke. Mitogeni signali uključuju aktivaciju MAPK signalnog puta. Za aktivaciju mitogenog signalinga obično je potrebna veća koncentracija inzulina u odnosu na onu potrebnu za aktivaciju metaboličkog signalinga. Dakle primarno će učinak inzulina pri nižim koncentracijama biti metabolički, a konkretno će ovisiti o tipu stanice na koju inzulin djeluje. Ipak ovaj učinak mogao bi biti poveznica između inzulinske rezistencije koja je povezana s višim razinama inzulina i mitogenog učinka inzulina koji bi mogao poticati rast tumora.
Stanice skeletnog mišićja veliki su potrošači energije tako da energiju koju eventualno mogu sačuvati koriste primarno za vlastite potrebe, uz izuzetak laktata koji otpuštaju prema jetri. Kada u krvi ima dovoljno glukoze inzulin to signalizira mišićnim stanicama i ona ulazi njihovu unutrašnjost gdje služi za sintezu glikogena. Nakon što je došlo do aktivacije inzulinskog receptora u stanicama skeletnog mišićja dolazi do premještanja transportera glukoze GLUT4 iz stanične unutrašnjosti na membranu stanice čime se zapravo stvara kanal za ulaz glukoze u stanicu. Glukoza u stanicama mišića može se iskoristiti za sintezu polimera glikogena za pohranu i daljnje korištenje ili se može direktno iskoristiti za stvaranje energije u procesu glikolize odnosno procesa kojim se tijekom razgradnje glukoze oslobađa energija potrebna za život stanica
Također treba imati na umu kako koncentracija inzulina u krvotoku nije svugdje jednaka, te je koncentracija koja se izlučuje iz gušterače u portalnu venu koja vodi prema jetri i 2-3 puta viša u odnosu na perifernu cirkulaciju. U jetri pak inzulin potiče sintezu svih ključnih makromolekula kao što su glikogen, lipidi i proteini. Istovremeno zaustavlja proizvodnju glukoze u jetri. Signalni put inzulina u stanicama jetre također započinje vezanjem na receptor i njegovom aktivacijom te aktivacijom nizvodnih proteina no u jednom se dijelu ti putevi razlikuju u odnosu na signalne puteve aktivne u skeletnom mišiću. Primarni učinak inzulina na jetru jest poticanje sinteze glikogena i taj je učinak također opisan u ranim fiziološkim studijama djelovanja ovog hormona. No, transport glukoze u stanice jetre nije reguliran inzulinom tako da ovaj hormon nema potpunu kontrolu nad sintezom glikogena u jetri. U jetri inzulin također utječe na lipidni metabolizam te potiče ekspresiju gena uključenih u de novo sintezu lipida. Neto učinak takvog djelovanja je da inzulin potiče skladištenje masti u stanicama jetre te smanjuje dostupnost masnih kiselina za oksidaciju u drugim tkivima. Utjecaj inzulina na sintezu proteina odvija se putem mreže proteina mTOR i predstavlja njegov anabolički učinak na stanice.
Masne stanice bijelog masnog tkiva su posebno osjetljive na inzulin i ključne za održavanje ravnotežnih koncentracija neesterificiranih masnih kiselina i glukoze u plazmi. Taj se učinak postiže kroz supresiju razgradnje triglicerida u stanicama masnog tkiva. Inzulin potiče i unos glukoze u adipocite iako u bijelo masno tkivo odlazi zapravo relativno mali udio glukoze u cijelom organizmu.
Uz ove izravne učinke inzulina na ciljna tkiva, poznat je i njegov neizravni utjecaj na ravnotežu metabolita s kojima nije u izravnoj interakciji no ipak putem molekula posrednika utječe na njihovu funkciju. Ovdje se radi o utjecaju inzulina na čitav organizam a takve je učinke teško aproksimirati modelima temeljenim na kulturi stanica, stoga je i razjašnjavanje ovih mehanizama u zaostatku za prethodno opisanim učinkom na pojedina tkiva. Ipak, oni su bitni i danas se smatra kako neizravni učinci inzulina predstavljaju veliki dio njegovog djelovanja u organizmu, a u nekim su situacijama i bitniji od neposrednog učinka na stanice. Primjer takvog neizravnog djelovanja je supresija glukoneogeneze u jetri na način da inzulin inhibira razgradnju masti u masnom tkivu, dakle djelovanjem na sasvim drugo tkivo postiže se konačni učinak u jetri. U neizravne učinke spada i utjecaj središnjeg živčanog sustava na metabolizam glukoze.
Zasad još ne možemo ciljano intervenirati u ove procese, no eventualno možemo promijeniti nešto u našem životnom stilu kako bismo barem usporili ove procese. Poznati čimbenici koji su u našoj kontroli su prehrana i tjelovježba. Odavno je poznato da pravilna prehrana i tjelesna aktivnost smanjuju rizik od pojave inzulinske rezistencije kao i njoj pridruženih metaboličkih bolesti, no molekularni mehanizmi nisu razjašnjeni. Pretpostavlja se kako vježbanje potiče stvaranje mitohondrija, energetskih tvornica u stanici, no veza između tog procesa i djelovanja inzulina nije razjašnjena. S druge pak strane neaktivnost primarno smanjuje osjetljivost mišićnog tkiva na inzulin dok je učinak na jetru zanemariv. Gubitak tjelesne mase također povećava osjetljivost tkiva na inzulin ali nije jasno da li je to u stvari učinak promjena u prehrani ili rezultat energetskih procesa kojim se troši višak masti u depoima u organizmu.
Iako pri spomenu inzulina vjerojatno prvo pomislite na ugljikohidrate, studije pokazuju kako nije jasno jesu li uistinu ugljikohidrati ili možda masti ključni za regulaciju inzulinske osjetljivosti
Iako pri spomenu inzulina vjerojatno prvo pomislite na ugljikohidrate, studije pokazuju kako nije jasno jesu li uistinu ugljikohidrati ili možda masti ključni za regulaciju inzulinske osjetljivosti. Pokazalo se kako dijete koje smanjuju masno tkivo ujedno povećavaju i inzulinsku osjetljivost. Prehrana s visokim udjelom proteina izaziva porast inzulinske rezistencije i pojavu metaboličkih bolesti dok su keto dijete odnosno dijete sa smanjenim unosom ugljikohidrata postale popularne upravo zbog svog hipoinzulinemičnog učinka. Također postoje indicije kako prehrana s visokim udjelom masti ne izaziva inzulinsku rezistenciju u mišićima ali izaziva rezistenciju u jetri.
Kakvu ulogu u inzulinskoj rezistenciji ima naša genetika?
Analize čitavog genoma nisu otkrile previše o genima koji sudjeluju u nastanku inzulinske rezistencije kao i metaboličkih bolesti općenito. Najvjerojatnije zato što je uloga pojedinih gena tkivno specifična pa tako nije svejedno hoće li se analizirati sistemski ili u nekom tkivu poput masnog tkiva ili mišića. S druge pak strane, danas znamo da su metaboličke bolesti prilično heterogene. Stoga iziskuju detaljnije karakteriziranje na razini kliničkih i biokemijskih manifestacija kako bi se iz fenotipa eventualno došlo do genetske podloge koja je taj fenotip dijelom prouzročila.
Razjašnjavanje molekularnih signalnih puteva unutar skeletnog mišićja, jetre i masnih stanica u kontekstu djelovanja inzulina bitno je osim zbog fundamentalnog znanja i zbog mogućnosti pronalaska novih markera za ranu detekciju poremećaja metabolizma glukoze i masti kao i novih meta za farmakološku intervenciju, možda čak i prije pojave ozbiljnih posljedica poremećaja ovih metaboličkih puteva. Prevencijom bolesti vezanih uz metabolički sindrom životni vijek i kvaliteta života sigurno bi se produžile jer su bolesti povezane s ovim sindromom najpogubnije za modernog čovjeka.
1) Menke A, Casagrande S, Geiss L, Cowie CC. Revalence of and trends in diabetes among adults in the United States, 1988–2012. JAMA 314: 1021–1029, 2015.
2) Petersen MC, Shulman GI. Mechanisms of Insulin Action and Insulin Resistance. Physiol Rev 98: 2133–2223, 2018.