medicina
Kako je razvoj složenih i skupih terapija za tumore omogućio proizvodnju nekih cjepiva protiv COVID-19. Pametni lijekovi
 Tamara Čačev / 10. travnja 2021. / Aktualno Članci / čita se 14 minuta
Tamara Čačev / 10. travnja 2021. / Aktualno Članci / čita se 14 minuta
 Tamara Čačev / 10. travnja 2021. / Aktualno Članci / čita se 14 minuta
Tamara Čačev / 10. travnja 2021. / Aktualno Članci / čita se 14 minuta

Kad je kolektivna svijest obilikovana kao da su zarazne bolesti negdje gdje prosječan zapadnjak neće nogom kročiti, onda ga puno više ga zanimaju lijekovi za neurodegenerativne ili tumorske bolesti. Stoga prioriteti u financiranju istraživanja i nisu bili u području razvoja novih cjepiva. Međutim, istraživanja novog pristupa u liječenju tumorskih bolesti, koji se svodio na ciljano stvaranje neoantigena karakterističnih za tumorske stanice nekog pojedinca kako bi imunološki sustav osobe stvorio na njih protutijela, mogao se primijeniti na stvaranje pandemijskog cjepiva temeljenog na RNA tehnologiji.
Narodna mudrost kaže: „Svako zlo za neko dobro“. Iako je utješna, vjerojatno nije uvijek istinita, no u slučaju pandemije koja nas još ne napušta može se primijeniti. Godinu dana od njenog početka imamo na raspolaganju različita cjepiva koja su razvijena zahvaljujući rudarskom poslu mnogih mojih kolega desetljećima prije nego li će njihov rad, tada smatran fundamentalnim i možda čak (usudimo li se to danas reći) nepotrebnim i neprimjenjivim istraživanjem, postati od presudne važnosti za čovječanstvo. Danas mnogi znaju da postoje vektorska i RNA cjepiva, no većina vjerojatno ne zna kako je za zapadni svijet uljuljkan u blagodati naprednog životnog standarda ideja o zaraznim bolestima i pandemijama više nalikovala na zaplet nekog filma nego na realnu mogućnost. A kad je kolektivna svijest obilikovana kao da su zarazne bolesti negdje gdje prosječan zapadnjak neće nogom kročiti, onda ga one i ne interesiraju. Puno više ga zanimaju neurodegenerativne ili tumorske bolesti koje su realnost dugoživućeg stanovništva najrazvijenijih zemalja. Stoga prioriteti u financiranju znanstvenih istraživanja većinom i nisu bili u području razvoja novih cjepiva. Tako je mala američka biotehnološka tvrtka Moderna započela s razvojem terapija tehnološki temeljenih na sintezi ciljanih RNA molekula kao novih pristupa u liječenju tumorskih bolesti. Ono što su oni nazvali personaliziranim cjepivom protiv raka temeljenom na molekulama mRNA zapravo je ciljano stvaranje neoantigena karakterističnih za tumorske stanice nekog pojedinca kako bi imunološki sustav osobe stvorio na njih protutijela, tako bio u stanju prepoznati tumor i uništiti ga. Sličnim smjerom istraživanja bavile su se i tvrtke BioNTech i CureVac koje su relativno brzo mogle prebaciti fokus svojeg poslovanja na stvaranje pandemijskog cjepiva temeljenog na RNA tehnologiji.
Ideja ‘tumorskih cjepiva’ posuđena je iz klasičnog principa našeg organizma o prepoznavanju stranoga. Takav je terapijski pristup sličan svojevrsnom cijepljenju protiv tumorskih stanica. U trenutku izbijanja globalne pandemije COVID-19 ove su tvrtke već imale razvijene algoritme prepoznavanja potencijalnih imunogenih meta u genomu tumora a koje nisu prisutne na normalnim stanicama. Nakon sekvenciranja genoma tumora pojedinca Moderna je u stanju izdvojiti do dvadesetak neoantigena specifičnih upravo za taj tumor te napraviti personaliziranu molekulu mRNA koja će zatim u organizmu oboljelog biti prevedena u proteinske ciljeve na koje će njegov imunološki sustav razviti najizgledniji odgovor. To znači da se tumor ciljano napada na dvadesetak mjesta odjednom i šansa da ga se uništi prije nego evoluira i izbjegne prepoznavanje višestruko se povećava. Princip možemo usporediti s istovremenom primjenom dvaju antibiotika koji udaraju na različite regulatorne puteve bakterije kako bismo bili sigurni da ćemo neku bakteriju efikasnije ukloniti iz organizma. Zahvaljujući tako razvijenim algoritmima bilo je moguće ovaj princip prepoznavanja najpogodnijeg antigena za izazivanje imunosnog odgovora primijeniti i na razvoj cjepiva te u svega nekoliko dana od objave sekvence virusa SARS-CoV-2 odabrati najbolju metu: bio je to protein Spike.
Ideja eridikacije tumora uz pomoć imunosnog odgovora pojedinca već je dugo prisutna no nisu postojale tehnologije kojima bi ona bila i ostvariva i dovoljno učinkovita i ciljana. Imunoterapija je smjer koji je ulazio i izlazio iz fokusa razvoja novih antitumorskih terapija no tek s mogućnošću stvaranja specifičnih ciljnih protutijela na neki od karakterističnih tumorskih proteina otvorilo se područje moderne imunoterapije koja danas pripada širem području tzv. pametnih lijekova. Uostalom, takve reakcije se svakodnevno događaju u našem organizmu te on uspijeva nizom različitih mehanizama ukloniti stanice koje imaju maligni potencijal i čini to prilično uspješno s obzirom na broj dioba stanica koje se odvijaju u organizmu tijekom našeg života. No, ni ovaj sustav nije 100% učinkovit. Ponekad neka od ovih stanica izbjegne sve prepreke i krene u svoj zloćudni pohod. Danas je poticanje ciljanog imunosnog odgovora na tumor ili na stanice njegovog mikrookoliša koje podržavaju njegov rast osiguravajući mu dotok hrane i kisika jedan od perspektivnijih smjerova u razvoju antitumorskih terapija i dodatni alat koji nas približava cilju da tumorske bolesti postanu zapravo kronične bolesti koje ćemo moći držati pod kontrolom pravovremenim prelaskom s jednog terapijskog pristupa na drugi.
Glasnička mRNA čiji je osnovni zadatak prijenos informacije s DNA (odnosno genskog zapisa) u konačni funkcionalni oblik a to je protein, tek je jedna u nizu raznih podvrsta RNA koje su otkrivene u stanici i prema najnovijim spoznajama čini tek manji dio tog RNA svijeta. Ostali tipovi RNA molekula prema onome što smo do sada saznali sudjeluju u regulaciji genske ekspresije odnosno reguliraju paljenje/gašenje pojedinih gena, sudjeluju u prekrajanju drugih RNA te djeluju na razini regulacije procesa u stanici iznad one genomske a koju stoga nazivamo epigenomskom regulacijom. Ova regulacija podložnija je utjecajima ad hoc promjena te se koristi za fino ugađanje signalizacije staničnih procesa. Upravo ove molekule nalaze se u centru novih terapijskih pristupa temeljenih na tehnologiji RNA molekula.
Iako je u najširoj javnosti najviše traga ostavio razvoj cjepiva temeljenog na mRNA tijekom 2020., prve (tržišno uspješne) terapije koje su bazirane na RNA tehnologiji odobrene su već 2018. godine u SAD i EU a radilo se o terapiji za jedan nasljedni oblik ATTR amiloidoze, bolesti u kojoj dolazi do nepravilnog nakupljanja proteina transtiretina u tkivima i organima što najviše pogađa živčani sustav i srce. Ovdje treba reći kako je i prije bilo pokušaja registriranja terapija temeljenih na RNA tehnologiji, primjerice pionirski poduhvat iz 1998.g. kada je odobren lijek fomivirsen za liječenje retinitisa uzrokovanog citomegalovirusom koji je nakon nekog vremena nestao s tržišta zbog male potražnje te uspona retroviralne terapije.
U grubim crtama trenutno se RNA terapije mogu podijeliti u nekoliko skupina (Slika 1):
Svima je konačni cilj onemogućiti sintezu ili funkciju mutiranog neispravnog proteina kada je ona nepravovremena i neregulirana te donosi štetu organizmu (takvi su primjerice onkogeni ili zbog mutacije trajno aktivni geni) ili u organizam unijeti uputu za sintezu funkcionalnog proteina ako je nativna verzija inaktivirana zbog mutacije (primjer su različite rijetke monogenske bolesti gdje poremećaj jednog gena može izazvati ogromne posljedice za funkcioniranje čitavog organizma).
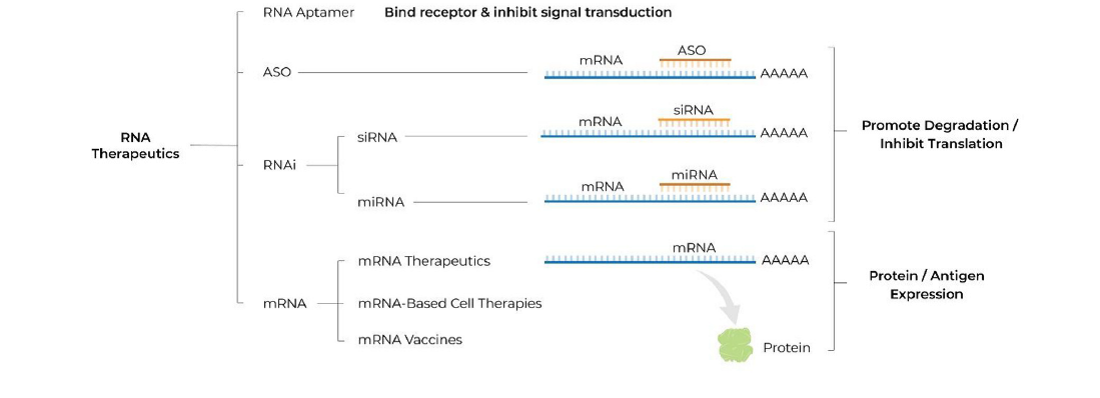
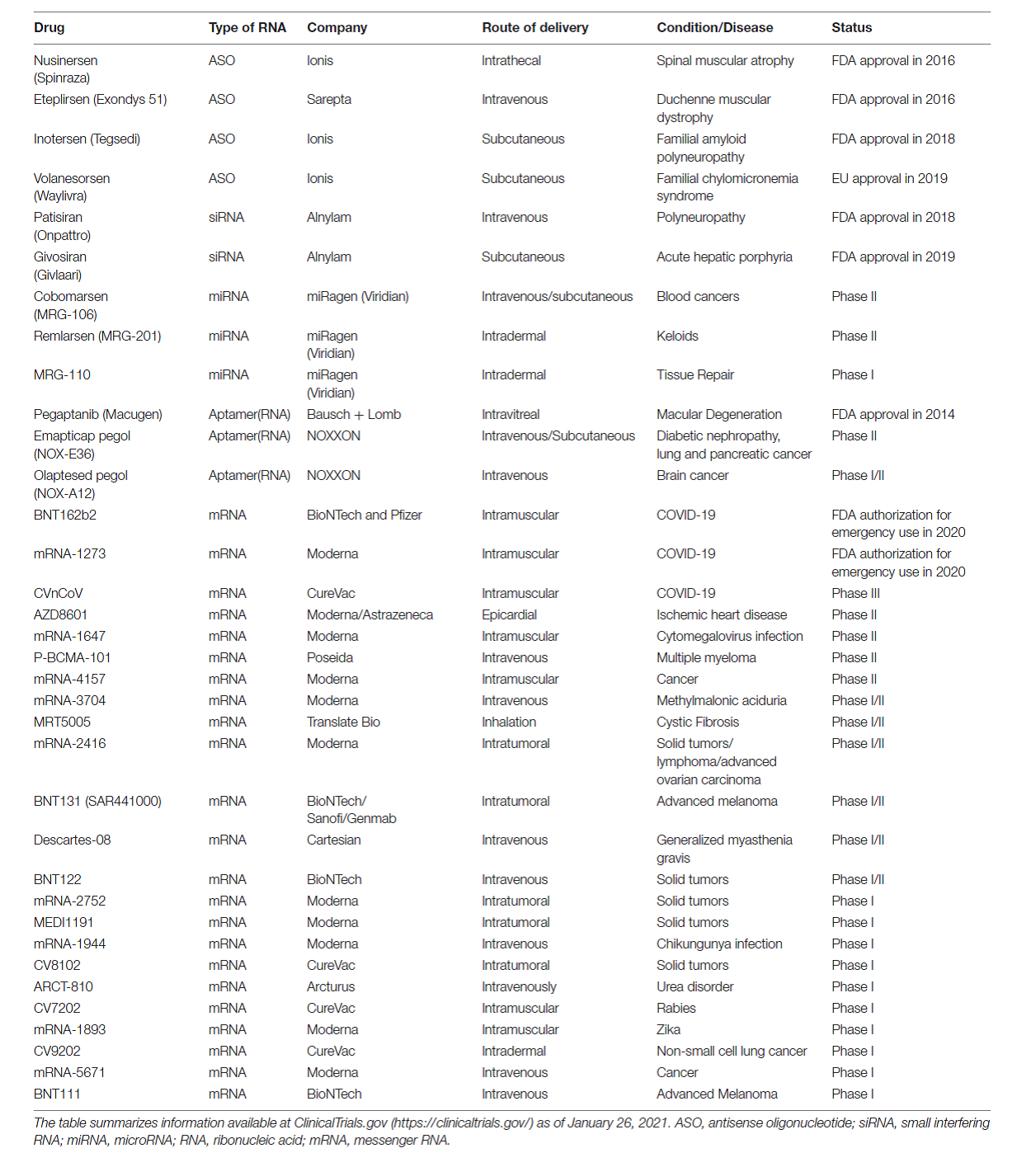
Na taj smo način zapravo intervenirali u funkcionalnost genoma ali ne i u njegov zapis. Dijelom je razlog tome što to još i nismo u stanju napraviti jako precizno unatoč tehnologijama genskih škara poput CRISPR-Cas9, a dijelom jer bi to povlačilo za sobom i etičke dvojbe povezane s trajnim i transgeneracijski prenosivim zadiranjem u genom čovjeka. Stoga je trenutno izvedivije i etički manje dvojbeno popravljati ‘štetu’ na koraku nakon samog čitanja nasljednog zapisa a to je njegova funkcionalna interpretacija. Može se postaviti pitanje zašto se onda ne intervenira direktno na sam protein? I stvarno, u slučaju da treba onemogućiti funkciju nekog aberantnog proteina to je danas moguće (u nekim slučajevima) napraviti putem ciljanih pametnih lijekova, no direktna suplementacija proteina s ciljem uvođenja u stanice većinom nije izvediva zbog toga što su naše stanice dizajnirane tako da same proizvode proteine koji im trebaju i nemaju mehanizme njihovog unošenja iz okoline (osim kada to tako nije u primarnoj funkciji proteina). Stoga danas u praksi imamo samo rijetke suplementacije proteinskog tipa poput inzulina, nekih čimbenika rasta i zgrušavanja čija je primarna funkcija zapravo da djeluju s vanjske strane stanice na samu stanicu. Neke od danas odobrenih terapija prikazane su na slici 2.
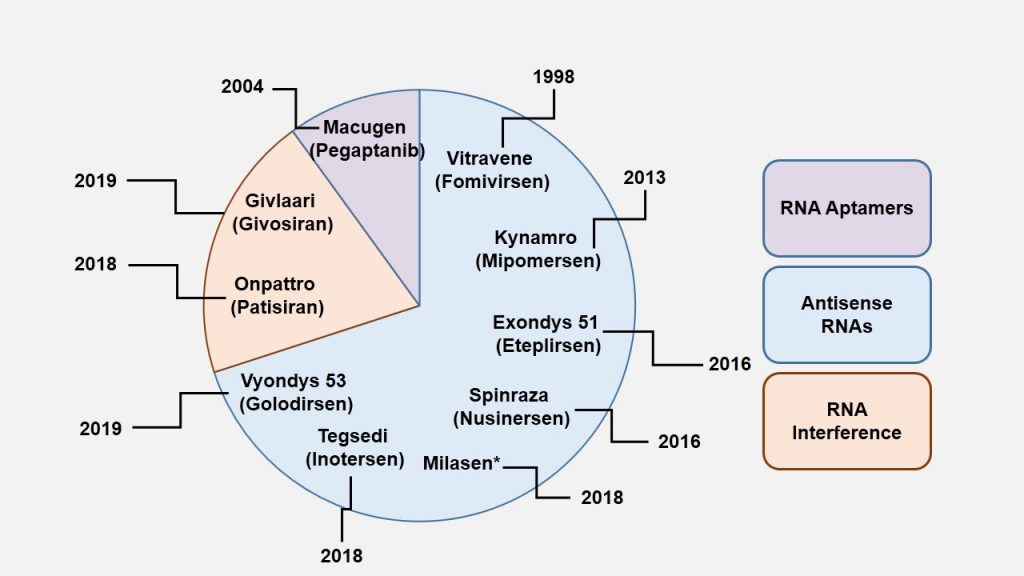
Kad govorimo o RNA terapijama koje ciljaju nukleinske kiseline tada mislimo na kratke jednolančane tzv. antisense oligonukleotide (ASO) ili na dvolančane molekule kojima se stanična regulacija napada putem mehanizma RNA interferencije (RNAi). U osnovi kod jednolančanih ASO molekula radi se o modificiranoj DNA koja koja se veže na ciljnu molekulu mRNA (čiji protein želimo ukloniti) i tako joj fizički blokira prepisivanje u protein ili je obilježava za degradaciju. Upravo na tom mehanizmu temelji se i jedan od prvih uopće odobrenih lijekova tog tipa Patisiran, lijek za ATTR amiloidozu.
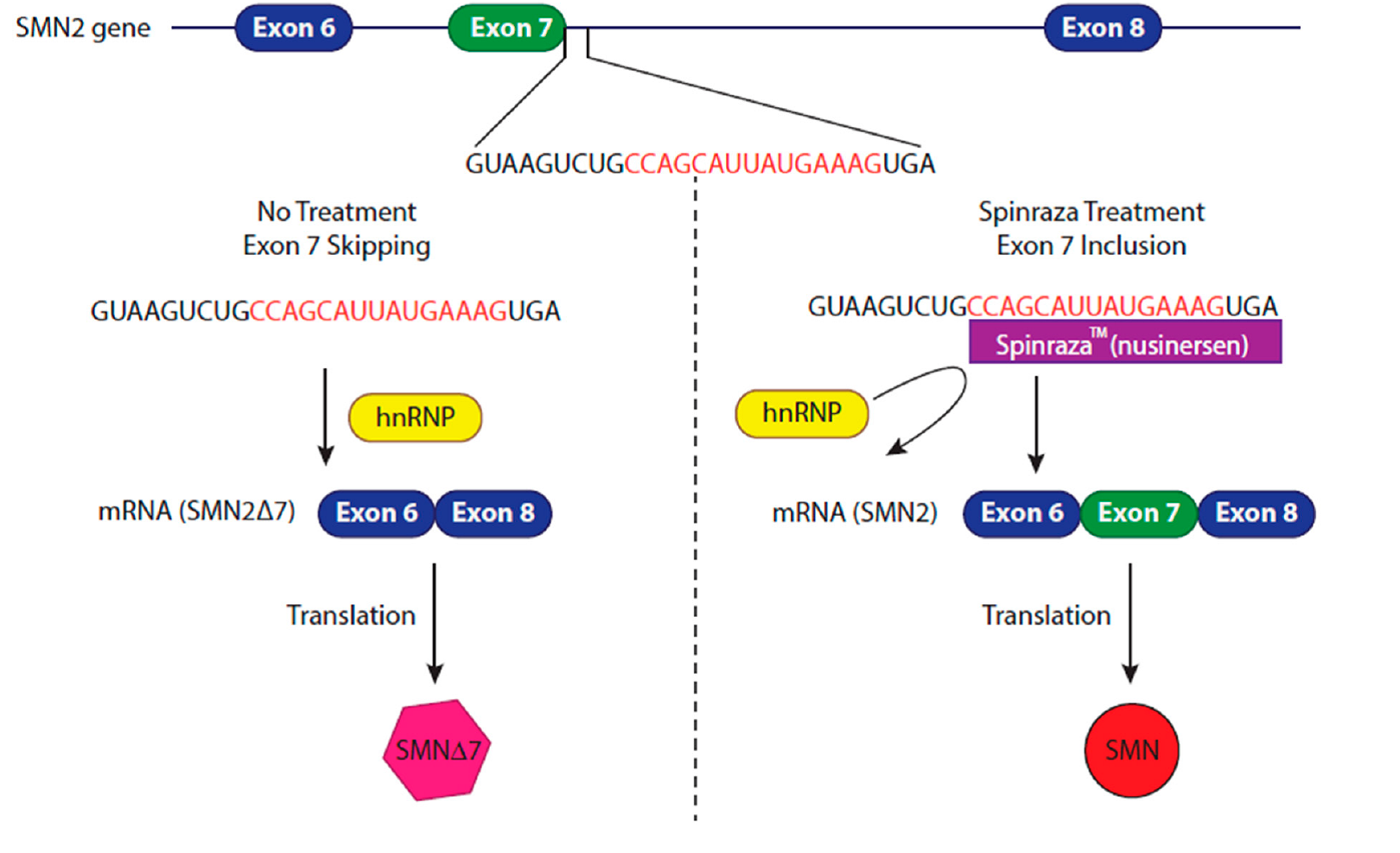
Antisense oligonukleotidi mogu poremetiti i procesiranje mRNA u njihov konačni zreli oblik pogodan za sintezu proteina. Tijekom 2016. u SAD-u su odobrene dvije nove terapije temeljene na ovim principima, jedna za spinalnu mišićnu atrofiju (Nusinersen) te druga (Eteplirsen) za Duchennovu mišićnu distrofiju. Ova potonja je posebno ingeniozna u zamisli a zatim i činjenici da je takova ideja na kraju i provedena. Naime, ovom terapijom antisens oligonukleotid ‘sjeda’ na mutirani dio gena te se on jednostavno izostavlja iz konačnog proteinskog produkta. Terapija za spinalnu mišićnu atrofiju postala je kod nas prva medijski eksponiranija terapija kada su roditelji oboljele djece tražili da se ovaj lijek pod komercijalnim nazivom Spinraza stavi na listu HZZO. Postavilo se tada i pitanje je li to uistinu opravdano skup lijek, koji je svojedobno proglašem i jednim od najskupljih lijekova uopće (terapija u prvoj godini košta 750 tisuća dolara a zatim svake godine po 350 tisuća dolara prema cijenama koje su aktualne u SAD) kada se u osnovi radi o lancima oligonukleotida. Naravno, cijena nije samo rezultat troška njegove sinteze nego i godina istraživanja kao i činjenice da su u to uložena ogromna sredstva za relativno mali broj oboljelih od ove bolesti u svijetu koja se zbog toga i svrstava u tzv.orphan diseases. Tako je i jedna bogata Danska suzila indikaciju za davanje ovog lijeka samo djeci u najranijoj životnoj dobi kada se i očekuje najbolji terapijski učinak, dok je primjerice u Hrvatskoj spektar osoba koje na nju imaju pravo puno širi. U ovoj bolesti zbog mutacija u genu SMN1 koji kodira za istoimeni protein dolazi do gubitka njegove funkcije i osobe preživljavaju zahvaljujući malim količinama ovog proteina koji se generira s drugog gena SMN2. Spinraza omogućava da se više produkta SMN2 usmjeri na procesiranje u smjeru konverzije u SMN1 te se na taj način povečava količina proteina SMN u središnjem živčanom sustavu te zaustavlja progresija ove bolesti u djece. Detaljniji mehanizam djelovanja Spinraze prikazan je na slici 3.
RNA terapije temeljene na mehanizmu RNA interferencije koriste kratke RNA molekule (siRNA ili mikroRNA) koje se vežu na ciljnu mRNA te na taj način sprečavaju njeno daljnje prevođenje u protein. Na ovome principu se temelji drugi odobreni lijek za prije spomenutu amiloidozu. Prošle godine također je u EU i SAD odobrena terapija temeljena na RNAi mehanizmu za primarnu hiperoksaluriju, rijetku bolest bubrega za koju do sada nije postojala adekvatna terapija te smo danas svjedoci sve većem broju ovakvih molekula u različitim fazama pretkliničkih i kliničkih ispitivanja.
Ova vrsta terapija cilja direktno proteine i temelji se na tzv. RNA aptamerima, molekulama koje se vežu na točno određena mjesta na ciljnom proteinu i na taj način modificiraju njegovu funkciju. Primjer ovakvog tipa terapije je lijek Pegaptanib koji je odobren za jedan oblik makularne degeneracije koja u svojoj etiologiji ima uraštanje krvnih žila u retinu čime dolazi do oštećenja vida. RNA aptamer se veže na VEGF koji je glavni čimbenik rasta endotelnih stanica krvnih žila čime se blokira njegova funkcija i smanjuje taj nekontrolirani rast žila u oku. Po sličnom obrascu razvijeni su i drugi aptameri koji ciljaju različite mete bitne u tumorskim bolestima poput receptora za faktore rasta ili onima koji kontroliraju prolazak stanica kroz stanični ciklus poput EGFR, HER2, HER3, PD-1/PD-L1 koji se nalaze u različitim fazama istraživanja. Druga potencijalna primjena RNA aptamera mogla bi biti primjerice u kontroliranju procesa koagulacije što je osobito važno u kritičnim stanjima diseminirane intravaskularne koagulacije ili tzv DIK-a koji je rezultat nekontroliranog stvaranja trombina i fibrina u krvotoku.
U ovu skupinu RNA terapeutika spadaju mRNA koje se koriste u razvoju prije spomenutih personaliziranih tumorskih cjepiva te naravno cjepiva za zarazne bolesti kakva su razvijena za SARS-CoV-2. Unošenje gena (putem DNA vektora) ili mRNA koja bi kodirala za neki protein koji nedostaje u cilju proteinske nadomjesne terapije bi također mogla korisititi primjerice oboljelima od hemofilije kojima nedostaje neki od faktora zgrušavanja. No, za razliku od primjene ove tehnologije kako bi se izazvao imunološki odgovor, ovdje proizvodnja proteina mora biti dugotrajna i relativno dobro regulirana što je proces koji se tek treba optimizirati kako bismo mogli reći da imamo sistemske RNA terapije.
Terapija temeljena na tehnologiji RNA te poticanje lokalne sinteze nekog ciljanog proteina ima svoju potencijalnu primjenu i u regenerativnoj medicini. Osim lokalne proizvodnje nekog proteina koji bi primjerice imao potencijal da poboljša zarastanje rana, mRNA tehnologija bi se mogla koristiti i za sintezu proteina koji bi djelovali sistemski odnosno koji bi se putem krvototoka proširili na čitav organizam. Na taj bi se način mogle stvoriti terapije za nadomještanje enzima u nekim rijetkim bolestima kao i primjerice proteina koji bi ‘pokrpali’ oštećenja srčanog mišića nakon srčanog udara. S druge pak strane korištenjem RNA tehnologije mogla bi se blokirati kaskada koja vodi u oštećenje srčanog mišića za što su neke molekule već u fazi kliničkog ispitivanja. U tablici 1 je popis RNA terapija odobrenih za kliničku primjenu ili su u nekoj od faza kliničkih ispitivanja.
Sintetizirati male molekule nukleinskih kiselina nije tehnički komplicirano ni skupo a rizik od neželjenih nespecifičnih učinaka mimo onog željenog je zahvaljujući sve boljim prediktivnim algoritmima svakim danom sve manji. Također, kako se radi o intervenciji na razini funkcije a ne genskog zapisa to dodatno olakšava etičke dvojbe koje bi mogle proizaći iz ovakvih intervencija. No, interveniranje na razini RNA ima i svoje otegotne okolnosti. Kako bi postizali kontinuirani učinak takvih terapija one se moraju kontinuirano administrirati za razliku od nekih potencijalnih budućih genskih terapija koje bi trebale biti jednokratni događaj izmjene zapisa u genomu. Dodatno, uz neku uvjetno rečeno patogenu funkciju (do koje dolazi zbog njihove nepravilne regulacije), mnogi proteini imaju višestruke vitalne funkcije u organizmu tako da ih se ne smije apsolutno dokinuti jer su potrebni i stanicama gdje nije prisutna patološka promjena. Upravo u tome i jest tajna uspješnosti tumorskih stanica jer koriste iste proteine našeg organizma samo ih manipuliraju da ih bude više ili manje. Također, velika prepreka terapijama temeljenim na RNA tehnologiji je dopremanje molekula RNA na pravo mjesto u pravo vrijeme u adekvatnim količinama kako bi bile učinkovite kao i regulacija njihove ekspresije.
U slučaju pandemijskog cjepiva stvar je bila relativno jednostavna jer je dovoljno da mRNA ili vektor uđe u bilo koju stanicu i pokrene proizvodnju proteina Spike koji će zatim uočiti elementi našeg imunološkog sustava i reagirati. U slučaju ciljanih terapija tumora potrebno je molekule dovesti do samog tumora kako bi bile učinkovite, a u slučaju terapija koje nadomještaju funkciju nekog unutarstaničnog proteina potrebno je da se on sintetizira upravo u tim stanicama ili barem na neki način dopre do većine njih. I dok je imunološka reakcija na protein u slučaju cjepiva poželjna, u slučaju suplementacije proteina izvana potrebno je takvu reakciju organizma izbjeći što nije trivijalna stvar iako u biti suplementiramo endogeni protein organizma. To su izazovi koje znanost tek treba riješiti, no ogromne količine sredstava koje su se slile u biotehnološke tvrtke tijekom ove pandemije daju nadu da će se ovi izazovi možda riješiti i prije negoli smo se tome nadali.
https://www.genomicseducation.hee.nhs.uk/blog/rna-based-therapies-two-types-explained/
https://www.news-medical.net/life-sciences/RNA-Therapeutics.aspx
https://www.labiotech.eu/in-depth/rna-therapeutics-covid-19/