entropija i strijela vremena
Kako vrijeme teče to je nered veći. Zašto krhotine spontano ne formiraju ponovo cijelu čašu?
 Dario Hrupec / 17. veljače 2021. / Članci / čita se 13 minuta
Dario Hrupec / 17. veljače 2021. / Članci / čita se 13 minuta

 Dario Hrupec / 17. veljače 2021. / Članci / čita se 13 minuta
Dario Hrupec / 17. veljače 2021. / Članci / čita se 13 minuta

Kad u nekom društvu netko prirodoslovne ili tehničke struke pokaže da ne zna tko je William Shakespeare, to je strašno i neoprostivo. No, kad u istom društvu netko društvene ili humanističke struke pokaže da ne zna za drugi zakon termodinamike, nikome ništa, pojeo vuk magare. A trebalo bi biti jednako strašno. Drugi zakon termodinamike jedan je od temeljnih zakona prirode, trebao bi biti dio opće kulture, no većini ljudi je špansko selo, piše Dario Hrupec.
Ne ponovilo se. Tako najčešće gledamo na proteklih 12 mjeseci koje će svijet pamtiti po pandemiji, a središnja Hrvatska još i po potresima. No, odmaknimo se malo od pandemije i potresa te se pozabavimo nečim apstraktnim, samim ponavljanjem. Ideja ponavljanja u temelju je koncepcije vremena. Zahvaljujući periodičnosti, procesima koji se pravilno ponavljaju, vrijeme možemo mjeriti. A zahvaljujući ireverzibilnosti, procesima koji su nepovratni, možemo percipirati jednosmjerni vremenski tijek ili strijelu vremena.
Malo je reći da je univerzum na mikroskopskoj razini čudan. Zapravo je krajnje bizaran. U subatomskom svijetu nema zvukova, nema boja, nema vremena. Bezbojni svijet potpune tišine još je zamisliv, ali što bi to značilo da vremena nema. Konkretno, jedan elektron koji opazimo danas ima potpuno ista svojstva koja je imao i kad je, u nekom procesu, bio stvoren, što je moglo biti prije 10 milijardi godina. Dakle, elementarne čestice ne stare. Nadalje, svaki proces na razini elementarnih čestica može se ravnopravno odvijati u jednom ili drugom smjeru, nema razlike. Od stanja A do stanja B ili od stanja B do stanja A, potpuno svejedno.
U makroskopskom svijetu nije tako. Pogledajte snimku jaja koje je palo sa stola i razbilo se. A onda pogledajte istu snimku unatrag: djelići s raznih strana skaču s poda na stol, spajaju se i na kraju čitavo jaje stoji na stolu. Drugi film odmah prepoznajemo kao nemoguć. Tako nešto se u našem svijetu ne događa. Jaja i čaše se ne odrazbijaju, starci se ne pretvaraju u djecu (barem ne u fizičkom smislu), čestice tinte koje su se raspršile po čaši vode nikad više ne oblikuju onu početnu kap koju smo bili ispustili u vodu. Zašto?
Navedeni primjeri možda su neshvatljivi iz perspektive svakodnevnog života. No, iz perspektive fizike koja opaziva svojstva objekata tumači iz atomske strukture tvari, stvari su prilično jasne. Postoji enormno veliki broj mikroskopskih konfiguracija, ili stanja, koja su ravnopravna i jednako vjerojatna. Međutim, broj makroskopskih stanja, koja smo u stanju razlikovati prema fizičkim veličinama koje možemo mjeriti, relativno je mali (u usporedbi s brojem mogućih mikroskopskih stanja).
Konkretnije: N različitih mikroskopskih stanja prepoznajemo kao isto makroskopsko stanje A, a M različitih mikroskopskih stanja prepoznajemo kao isto makroskopsko stanje B. Ako M i N nisu isti brojevi nego je, recimo, M veći od N onda je vjerojatnost stanja B veća nego vjerojatnost stanja A. Sustav prepušten sam sebi, bez vanjske intervencije, zbog unutrašnjih interakcija dolazi u neko mikroskopsko stanje, svejedno koje. Sva su mikroskopska stanja jednako vjerojatna. Ali iz naše, makroskopske, perspektive sustav završava u onom stanju koje je vjerojatnije, koje ima više mogućih mikroskopskih realizacija. U gornjem primjeru, spontano (sam od sebe) može prijeći jedino iz A u B. Ireverzibilnost se, dakle, iskazuje kad fizički sustav postane dovoljno složen, a za njezin matematički opis potrebna je vjerojatnost i statistika.
Čovjek koji je to prvi shvatio i matematički opisao bio je austrijski fizičar Ludwig Boltzmann. On je otkrio da je logaritam broja mikrostanja fizičkog sustava s velikim brojem čestica (a najjednostavniji takav sustav je idealni plin), koja odgovaraju jednom te istom makrostanju, proporcionalan entropiji, fizičkoj veličini koja je ranije bila uvedena u termodinamici. Tako je Boltzmann entropiji dao interpretaciju mjere nereda u sustavu, a drugom zakonu termodinamike statističko tumačenje. Sve ovo zaslužuje detaljniju priču.

Činjenicu da se sve tvari, od kojih smo građeni i koje nas neposredno okružuju, sastoje od atoma danas uzimamo kao temeljnu i neupitnu. Obično se spominje da ideja atoma potječe još od starih Grka, Leukipa i Demokrita, pa se stječe dojam da je atomska građa tvari oduvijek poznata. Krivo! Atomizam je bio tek jedna filozofija na koju su mnogi utjecajni fizičari još početkom 20. stoljeća gledali s prijezirom.
Boltzmann je atome tretirao kao stvarne fizičke objekte. Na atomsku je hipotezu primijenio statistiku i povezao makroskopske veličine, one koje možemo opažati, u određene zakonitosti. Taj njegov rad poznat je kao kinetička teorija plinova. Danas je to jedan od temelja moderne fizike, no u Boltzmannovo doba nije bilo tako. Tadašnji veliki autoriteti, primjerice Ernst Mach i Wilhelm Ostwald, bili su žestoki protivnici ideje atoma kao stvarnih objekata. Primjerice, na jednoj važnoj konferenciji 1904. godine njegov su rad svrstali u primijenjenu matematiku. Boltzmanna je to jako pogađalo. Kako je inače bio osjetljiv i sklon depresijama, na kraju se ubio.
Drugi fizičar, koji se nije dao smesti i čije je vrijeme tek dolazilo, Albert Einstein, u to je doba ideju atoma primijenio na problem poznat kao Brownovo gibanje. Godine 1905. objavio je četiri rada koja su iz temelja promijenila fiziku. U jednom je objasnio fotoelektrični učinak (što mu je kasnije donijelo Nobelovu nagradu), u drugom je uveo ono što danas nazivamo posebnom teorijom relativnosti, u trećem je opisao jednu od posljedica posebne teorije relativnosti (danas poznatu kao najslavnija jednadžba fizike, E = mc2) i u četvrtom radu, premda ne tim redom, objasnio je Brownovo gibanje na temelju atomske hipoteze. Bila je to jedna od ključnih potvrda atoma kao stvarnih fizičkih entiteta. Eto, za one koji to još nisu znali: Einstein je između ostalog pokazao da atomi nisu tek filozofska ideja nego fizički entitet.
Boltzmann je bio u pravu. Statističkom analizom mnoštva atoma mogu se mikroskopska stanja povezati s mjerljivim veličinama poput entropije. Na njegovoj nadgrobnoj ploči, u Beču, stoji njegova slavna formula S = k ln W, koja broj mikroskopskih stanja W povezuje s entropijom S. Veličinu k danas nazivamo Boltzmannovom konstantom i ona je jedna od sedam prirodnih konstanti na temelju kojih je danas definirano sedam osnovnih mjernih jedinica međunarodnog sustava.
Entropija je izvorno bila uvedena kao termodinamička veličina čija promjena odgovara omjeru promjene topline i apsolutne temperature. Sredinom 19. stoljeća tu je veličinu uveo njemački fizičar Rudolf Clausius da bi opisao “količinu transformacije”. Blisko je vezana s energijom, otud prva dva slova, EN. Drugi dio riječi, TROPIJA, dolazi od grčke riječi za transformaciju: trepo (τρέπω).

Clausius je jedan od utemeljitelja klasične termodinamike, područja fizike koja mjerljivim makroskopskim veličinama (temperaturom, tlakom, volumenom, količinom tvari) opisuje promjene fizičkih sustava povezane s toplinom. Toplina je onaj dio energije koji prelazi s tijela na tijelo, ili s jednog dijela sustava u drugi dio sustava. Zato toplinu nazivamo energijom prijelaza. Pri takvim prijelazima energije s tijela na tijelo moguće je jedan dio energije preusmjeriti za obavljanje nekog posla. Taj dio energije onda nazivamo radom. Onaj dio energije prijelaza koji završi na drugom tijelu poveća unutrašnju energiju tijela, što se ispoljava povećanjem temperature.
Dakle, i toplina i rad i unutrašnja energija su pojavni oblici energije. I te su energije, naravno, povezane. Veza se može izreći ovako: toplina koju predamo tijelu dijelom ode na povećanje unutrašnje energije, a dijelom na obavljanje rada. Tu fundamentalnu zakonitost prvi put je jasno formulirao Clausius, 1850. godine, a kasnije je postala poznata kao prvi zakon termodinamike. Isto tako, kasnije se uvidjelo da je prvi zakon termodinamike samo posebni slučaj općenitijeg zakona: zakona očuvanja energije. To je temelj temelja fizike. Poricanje zakona očuvanja energije povlači rušenje kompletne zgrade fizike. To tako dramatično ističem jer ću mi kasnije trebati, kad dođem do pojma perpetuum mobilea.
Prvi zakon termodinamike ne postavlja nikakvo ograničenje na broj prijelaza energije unutar sustava odnosno na količinu transformacija. Presipavanja “iz šupljeg u prazno” mogu se odvijati zauvijek. No, već je Clausius uvidio da broj transformacija nije neograničen. Zato je uveo entropiju, mjeru količine transformacija
Zakon očuvanja energije vrlo je jednostavan: ukupna energija zatvorenog sustava je očuvana. Očuvana znači da se ne mijenja s vremenom. A zatvoren sustav znači sustav odvojen od okoline u smislu da s okolinom ne izmjenjuje ništa, ni materiju ni energiju te da na sustav ne djeluju nikakve vanjske sile. Ako je to ispunjeno onda je ukupni iznos energije stalan. Što ne znači da se ništa ne može događati. Energija može teći unutar tog zatvorenog sustava, prelaziti s jednog dijela sustava na drugi. Ali, ukupni zbroj energije mora ostati konstantan.
Prvi zakon termodinamike ne postavlja nikakvo ograničenje na broj prijelaza energije unutar sustava odnosno na količinu transformacija. Što se prvog zakona tiče, presipavanja “iz šupljeg u prazno” mogu se odvijati zauvijek. No, već je Clausius uvidio da broj transformacija nije neograničen. Zato je uveo entropiju, mjeru količine transformacija. I na toj razini entropija je vrlo apstraktna veličina, koja je laiku manje shvatljiva od teorije relativnosti ili kvantne fizike. Tek s Boltzmannovom statističkom interpretacijom entropija će dobiti svoj jasan smisao, a drugi zakon termodinamike još jedan izričaj.
Drugi zakon termodinamike osebujan je na mnoge načine. Prvo, on je, s jedne strane, jedan od temeljnih zakona prirode, a s druge strane, većini ljudi špansko selo. Obično se navodi kao primjer znanja koje bi trebalo biti dio opće kulture. Recimo, kad u miješanom društvu netko prirodoslovne ili tehničke struke pokaže da ne zna tko je William Shakespeare, to je strašno i neoprostivo. No, kad u istom društvu netko društvene ili humanističke struke pokaže da ne zna za drugi zakon termodinamike, nikome ništa. Pojeo vuk magare. A trebalo bi biti jednako strašno. O tome je u svojem poznatom eseju Dvije kulture davno već pisao C. P. Snow.
Osim toga, drugi zakon termodinamike predstavlja svojevrsne stilske vježbe za fizičare. Naime, moguće ga je izraziti na mnoge, naizgled različite, načine. Evo nekih izričaja drugog zakona:
1) Francuski inženjer Sadi Carnot, koji se bavio usavršavanjem parnog stroja, pokazao je, 1824. godine, da učinkovitost pretvaranja topline u rad kod toplinskog stroja ima svoju gornju granicu. Ta je granica uvijek manja od 100%, čak i kod idealnog toplinskog stroja. Carnot to svoje otkriće nije zvao drugim zakonom termodinamike, no mi ga danas prepoznajemo takvim. Naime, činjenica koju je Carnot prvi formulirao izravna je posljedica drugog zakona termodinamike. Ili obrnuto, drugi zakon se može izraziti preko te činjenice. Usput, Carnot je umro mlad, u svojoj 36. godini, od kolere čija je epidemija vladala 1832. godine.
2) Već spomenuti Rudolph Clausius je 1850. godine drugi je zakon termodinamike formulirao kao činjenicu da toplina ne može spontano prijeći s hladnijeg na toplije tijelo. Takav prijelaz topline nije apsolutno nemoguć, ali je nemoguć “sam od sebe”. Tu je zgodna analogija s vodom. Voda će sama od sebe teći nizbrdo, ali neće sama od sebe teći uzbrdo. Može “teći” i uzbrdo ako joj pomognemo, recimo pumpama. Drugim riječima, može uzbrdo ali uz ulaganje energije. Tako i toplina može teći s hladnijeg tijela na toplije, uz ulaganje energije. Primjer koji imate kod kuće je hladnjak. Da bi tjerao toplinu “uzbrdo” mora biti uključen.
3) Nije moguć toplinski stroj koji bi, ponavljajući kružni proces, svu toplinu iz jednog spremnika pretvarao u rad. Potrebna su dva spremnika topline, topliji i hladniji. Jedan dio topline koja, u svakom ciklusu, prelazi iz toplijeg spremnika na hladniji, može se iskoristiti za obavljanje rada. Samo dio, ne sva toplina. To je vrlo blisko izvornoj Carnotovoj formulaciji drugog zakona. Uz definiciju učinkovitosti, kao omjera dobivenog rada i uložene topline, svodi se na 1).
4) Perpetuum mobile druge vrste nije moguć. Podsjetimo se, perpetuum mobile (doslovno, vječno pokretan) je hipotetski uređaj koji bi obavljao rad mukte, ni iz čega, trikom. Oni koji su ga pokušavali konstruirati bili su uvjereni da mogu naći neku jako pametnu inženjersku doskočicu kojom bi nadmudrili prirodu. Perpetuum mobile prve vrste narušavao bi prvi zakon termodinamike odnosno zakon očuvanja energije, a perpetuum mobile druge vrste narušavao bi drugi zakon. No, koji god zakon narušili, prvi ili drugi, s njime se ruši i cijela zgrada fizike pa bi izumitelj ujedno bio donositelj takve revolucije u fizici kakvu nisu donijeli svi dosadašnji fizičari zajedno. Vrlo ambiciozan plan, mora se priznati. A takve ambicije mogu imati samo oni koji o fizici baš ništa ne znaju. Da takvih ljudi ima, nije čudo. Ali da ima onih koji će im dati priliku da govore na znanstvenoj tribini, e to je čudo. I to se čudo dogodilo u zagrebačkoj Gradskoj knjižnici, prije točno godinu dana, što sam bio opisao u članku Sredstvima Grada Zagreba promoviraju perpetuum mobile, i što se može dodati u one pošasti s početka teksta za koje sam zavapio: ne ponovilo se.
5) Entropija zatvorenog sustava može samo rasti. Ili, promjena entropije zatvorenog sustava uvijek je veća od nule. Doduše, za reverzibilni sustav promjena bi bila jednaka nuli, no to je ionako idealizacija. Svi realni sustavi su ireverzibilni pa entropija svakog zatvorenog sustava može samo rasti.
I sad se možemo vratiti Boltzmannu koji je pokazao da se entropija može prikazati, do na konstantu, kao logaritam broja mikroskopskih stanja. S obzirom na to da su sva mikroskopska stanja jednako vjerojatna, ali da mnoga mikroskopska stanja odgovaraju istom makroskopskom stanju, onda spontani prijelaz u neko mikroskopsko stanje povlači spontani prijelaz u vjerojatnije makroskopsko stanje. A to stanje ima više mogućih mikroskopskih realizacija W, pa je lnW veći, pa je entropija S veća. Dakle, sustav spontano prelazi u stanje veće entropije. Nadalje, više mogućih mikroskopskih realizacija za isto makroskopsko stanje znači da manje znamo kakvo je unutrašnje uređenje sustava. Drugim riječima, znači da je sustav manje uređen, odnosno više neuređen, da je u većem neredu. Zato entropiju možemo interpretirati kao mjeru nereda u sustavu. A drugi zakon termodinamike možemo formulirati posve u skladu sa svakodnevnim iskustvom: nered (spontano i u zatvorenom sustavu) s vremenom može samo rasti.
Na temelju drugog zakona termodinamike engleski fizičar Arthur Eddington bio je predložio koncepciju strijele vremena, u svojoj knjizi Priroda fizičkog svijeta iz 1928. godine. Rekao je otprilike ovako: kroz niz stanja svijeta povučemo zamišljenu strijelu; ako u smjeru strijele nalazimo stanja sa sve više nasumičnosti onda strijela pokazuje prema budućnosti; ako u smjeru strijele nalazimo stanja sa sve manje nasumičnosti onda strijela pokazuje prema prošlosti.
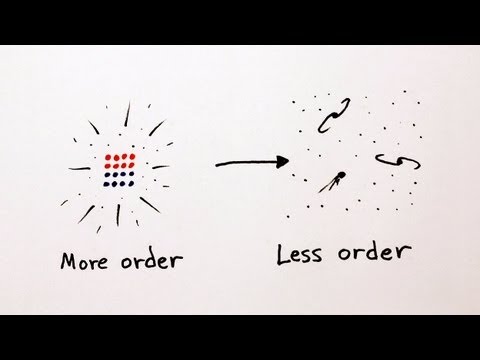
Najjednostavnijim riječima, strijela vremena je jednosmjernost vremena ili asimetrija vremena. Evo jednostavnog primjera za vizualizaciju asimetrije. Dužina je dio pravca omeđen s dvije točke. Obje te točke su ravnopravne. Ako dužinu zrcalno preslikamo s obzirom na os koja je okomita na dužinu i prolazi kroz njezino središte, opet smo na istom. Imamo što smo i imali. To je primjer simetrije. Ako toj istoj dužini odredimo početnu i konačnu točku dobili smo usmjerenu dužinu ili geometrijski prikaz vektora. Konačnoj točki obično nacrtamo vrh strelice. Ako tu strelicu zrcalno preslikamo, na gore opisani način, više nemamo ono što smo imali, početak i kraj su zamijenili mjesta, vrh strelice je sada s druge strane. To je primjer asimetrije. Zato je Eddington svojstvo asimetrije vremena vizualizirao strijelom.
Tu Eddingtonovu strijelu vremena nazivamo termodinamičkom strijelom vremena. Ona proizlazi iz kozmološke strijele vremena, koja pokazuje smjer širenja svemira. Iz termodinamičke strijele vremena proizlazi pak psihološka strijela vremena, koja određuje našu percepciju vremena, a temelji se na sjećanju (sjećamo se prošlosti, ali ne i budućnosti) i volji (osjećamo da možemo utjecati na budućnost, ali ne i na prošlost).