MOLEKULARNA BIOLOGIJA
Kolaž mutacija u našim tijelima. Istraživanje somatskog mozaicizma
 Tamara Čačev / 21. ožujka 2025. / Perspektive / čita se 13 minuta
Tamara Čačev / 21. ožujka 2025. / Perspektive / čita se 13 minuta

 Tamara Čačev / 21. ožujka 2025. / Perspektive / čita se 13 minuta
Tamara Čačev / 21. ožujka 2025. / Perspektive / čita se 13 minuta

Danas shvaćamo kako zapis koji dobijemo sekvenciranjem genoma neke osobe zapravo ne predstavlja svaku stanicu njegovog organizma, piše Tamara Čačev. Naša su tkiva poput prekrivača od zakrpa, sastavljenih od većeg broja manjih komadića tkanine, a znanstvenike je posljednjih godina iznenadila količina mutacija prisutnih u zdravim i normalno funkcionirajućim stanicama.
Jeste li se ikada zapitali koliko je dugo slonica trudna? Uvjerljivo najdulje u životinjskom svijetu, 22 mjeseca, slijede je zatim orke (18 mjeseci) te ženke nosoroga, deve i žirafe s oko 15 mjeseci. Nasuprot njima, gestacija kod miševa, hrčaka i štakora je oko tri tjedna. Ima li u ovome neke logike? Naravno da ima, dovoljno je pogledati razliku u veličini ovih životinja. I jedne i druge kreću od oplođene jajne stanice, ali prva skupina mora „napraviti“ velikog sisavca i to jednostavno traje duže. Kako bismo dobili slonića od 80-100 kg mora se dogoditi neusporedivo više dioba stanica nego za malog mišića od 0.5-1.5 grama.
Svi u školi uče što je dioba stanica – mitoza, kojom nastaju tjelesne (zovemo ih i somatske) stanice organizma, a to se događa tijekom trudnoće. Suprotno tome, drugi oblik diobe stanica je mejoza kojom nastaju spolne stanice s upola manje genetskog materijala kako bi se ta količina opet dovela na „standardnu“ spajanjem spolnih stanica u oplodnji, pri čemu jednu polovinu, da to tako pojednostavnimo, dobivamo od oca a drugu od majke. Nakon tog inicijalnog miksanja genetskog materijala, fokus se mijenja i iz procesa inovacije i nastanka novog jedinstvenog organizma s jedinstvenim genetičkim kombinacijama, prelazimo u fazu kopiranja genetičkog materijala.
Ideja svih daljnjih dioba u našem organizmu dakle nije inovativnost već reproducibilnost i kopiranje iz diobe u diobu kako bismo dobili dovoljnu tjelesnu masu potrebnu za samostalan život. Nema tu mjesta za nekakve daljnje improvizacije, od mladunca slona mora nastati slon u slonovskim gabaritima s glavnim slonovskim karakteristikama poput surle, kljova i ogromnih kutnjaka. Svi se mi morfološki razlikujemo a opet smo napravljeni po zadanom arhitektonskom nacrtu, na stranu što na razini promatranja samih procesa u stanicama slona možda i ne bismo mogli razlikovati od čovjeka jer su ti esencijalni molekularni mehanizmi funkcije stanica zacrtani već kada je prvi višestanični organizam ugledao svjetlo dana.
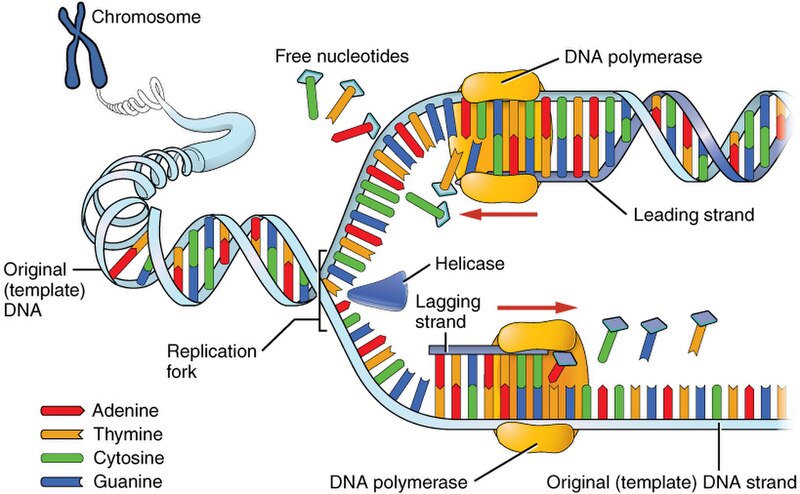
Logično je da pri svakoj diobi stanica moramo udvostručiti sve elemente stanice pa tako i molekule DNA u procesu koji nazivamo DNA replikacija. Glavni enzimi koji u tome sudjeluju su DNA polimeraze i one moraju biti iznimno točne u prepisivanju zapisa prilikom njegovog kopiranja. Ne smiju puno griješiti jer se radi o tekstu koji u slučaju čovjeka sadrži 3.2 milijarde slova (nukleotida). To vam je oko 1.6 milijuna stranica teksta ili oko 6.500 knjiga prepisivanja za samo jednu stanicu u diobi, a smatra se kako u svakom trenutku u organizmu imamo i do 4 milijuna stanica koje se dijele. I pazite, postoji i vremensko ograničenje u kojem se to čitanje i prepisivanje mora dogoditi, najbolje to vidite kad se porežete a rana se mora nadograditi novim stanicama.
Intrinzična greška DNA polimeraza čovjeka (bez „lektoriranja“ – proofreadinga ili, ako hoćete, autocorrecta) iznosi 1 na 10⁴ do 10⁵ nukleotida. To znači da se pri replikaciji cijelog genoma dogodi između 320 tisuća i 3,2 milijuna grešaka u zapisu a to su zapravo mutacije. No, DNA polimeraze svojom sposobnošću lektoriranja vlastitog rada uspijevaju broj grešaka smanjiti na 1 na 10⁶ do 10⁷ nukleotida. Ovim mehanizmom broj grešaka u ljudskom genomu smanjuje se na 320 do 32 tisuće mutacija po replikaciji. Nakon procesa replikacije postoje i dodatni korekcijski mehanizmi popravka krivo sparenih baza (MMR, engl, mismatch repair) kojim se broj grešaka smanjuje na 1 na 10⁹ do 10¹⁰ nukleotida čime dolazimo do prosječno 0.3 do 1 mutacije u genomu po replikaciji molekule DNA.
Mala nepreciznost otvara vrata novim genetskim rješenjima koja su potencijalno bolje prilagođena promjenama u okolišu
Je li to puno ili malo? Ljudske DNA polimeraze uz sve korektivne mehanizme postižu izuzetno visoku preciznost, za to se troše enormni energetski resursi, ali ipak dolazi do rijetkih mutacija, koje mogu biti neutralne, štetne ili korisne za evoluciju. Spolne stanice imaju polimeraze koje su još preciznije kako bi se osiguralo da se što manje grešaka prenosi na sljedeću generaciju, no niti one nisu 100% precizne. Upravo ta mala nepreciznost otvara vrata novim genetskim rješenjima koja su potencijalno bolje prilagođena promjenama u okolišu i silama koje tjeraju evolucijske prilagodbe.
Tjelesne stanice prolaze kroz mnogo više dioba tijekom života, što povećava mogućnost za akumulaciju mutacija. Starenjem i izloženošću mutagenima (UV zračenje, kemikalije, oksidativni stres) dodatno raste potencijalni broj mutacija u nekoj stanici. Ako se radi o stanicama koje su dio tkiva koja se moraju obnavljati diobom kako bi se stare oštećene stanice zamijenile novima, kako je to slučaj primjerice matičnim stanicama kože ili probavnog sustava, postaje jasno kako broj potencijalnih mutacija tijekom života u takvim stanicama s vremenom raste. I tako smo došli do klasične definicije tumorigeneze a to je proces akumuliranja mutacija u stanicama koji dovodi do njihove nekontrolirane diobe. Sad je jasnije zašto se tumorske bolesti koje nemaju nasljednu komponentu javljaju s višom incidencijom u starijoj životnoj dobi. U boljoj su poziciji stanice koje se rijetko ili uopće ne dijele poput neurona. No, i u njima dolazi do akumulacije grešaka uslijed oštećenja kojima su izložene. Tako danas smatramo kao je i neurodegeneracija posljedica akumulacije oštećenja koja se ne mogu popraviti u stanici. Od one početne oplođene jajne stanice pa do neke stanice kože starije osobe može se dogoditi i na tisuće mutacija. One ne moraju biti maligne, ali jasno je da takva stanica više ne funkcionira u potpunosti jednako kao neka njena mlađa prethodnica. To najbolje možemo shvatiti kada pogledamo kožu novorođenčeta i starije osobe.
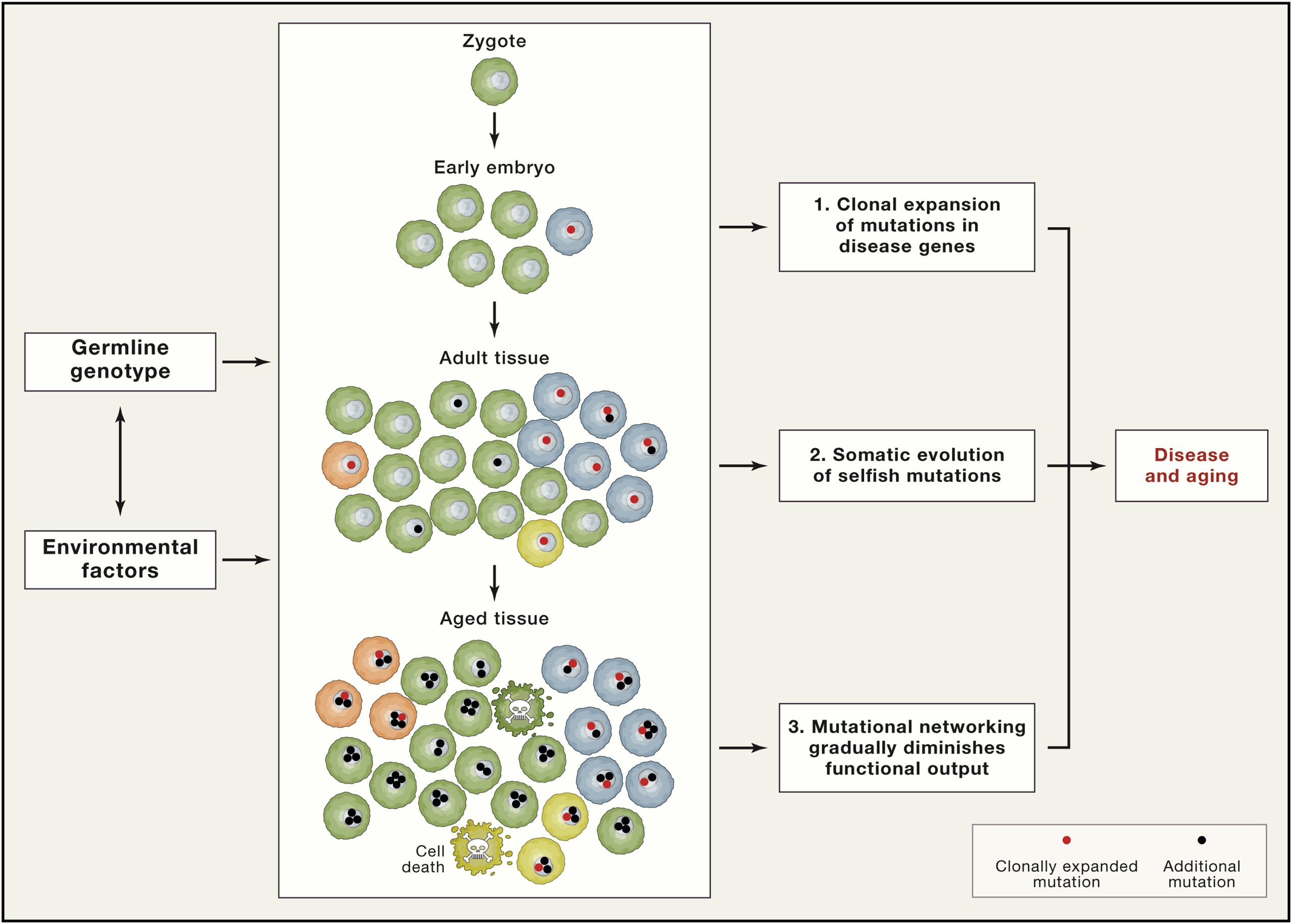
Kada je sekvenciran prvi genom čovjeka, dobivena sekvenca DNA nije bila sekvenca samo jedne osobe već nekoliko desetaka. Tako je nastao prvotni konsenzusni genom čovjeka i svaka sljedeća dobivena sekvenca DNA u nekoj se mjeri razlikovala od tog konsenzusa. Te varijacije u genomu danas i ne nazivamo mutacijama već polimorfizmima (najčešće ćete se susresti sa SNPovima), upravo zbog toga što nisu nužno patogene, već nas samo čine različitima. To je vidljivo na primjeru različitih boja kose ili očiju, ali i mnogih drugih naših svojstava – primjerice načina kako metaboliziramo neke lijekove. No, kako ni taj prvotni genom čovjeka nije ultimativno mjerilo kako izgleda genom svakog pojedinca, danas shvaćamo kako ni zapis koji dobijemo sekvenciranjem genoma neke osobe ne predstavlja svaku stanicu njegovog organizma.
Moramo naime imati na umu da su najčešće tkivo koje se uzima kao početni materijal za sekvenciranje – stanice krvi, ili tkiva tumora ako se radi o sekvenciranju u cilju dijagnostike. Zbog prethodno opisanih grešaka DNA polimeraza pri replikaciji DNA, kao i oštećenja DNA vanjskim čimbenicima, sekvenca DNA koju dobijemo iz stanica krvi nije apsolutna preslika sekvence DNA u našim neuronima osim ako smo naslijedili neku genetsku promjenu od roditelja pa je ona po prirodi replikacije i nastanka višestaničnog organizma prisutna u svim našim stanicama. Stoga je sekvenca koju dobijemo sekvenciranjem našeg genoma iz većeg broja stanica krvi opet reprezentativna za većinu naših stanica, no ne i za svaku pojedinu, zbog mehanizama nastanka mutacija o kojima je prethodno bilo riječi. Mi smo dakle tjelesni (somatski) mozaici sačinjeni od stanica čije se DNA razlikuju, a ta pojava se naziva somatski mozaicizam.
Zamislite one patchwork prekrivače koji su bili moderni 80ih, sastavljene od puno manjih komadića tkanine, tako u genomskom smislu izgledaju i naša tkiva. Nije da toga nismo bili svjesni barem na teorijskoj razini već davno prije, no nedostajala je tehnologija sekvenciranja na razini jedne stanice, kojom je to konačno potvrđeno.
Jer teško je, ako se sekvencira veći broj stanica uzetih iz nekog tkiva, uloviti neku promjenu koja je prisutna u manjem broju stanica naspram većine stanica sa standardnim genomom. Naprosto je bilo teško razlučiti taj signal od pozadinskog šuma koji dolazi od genoma većine ostalih stanica. No, iako smo teorijski bili svjesni te mogućnosti, može se reći kako smo ostali možda malo zatečeni količinom mutacija prisutnih u normalno funkcionirajućim i (zasad) zdravim stanicama.
Primjerice, kada su istraživani ostaci tkiva nakon blefaroplastike, uklanjanja viška kože s kapaka, ispostavilo se da je u tim komadićima starijih osoba 20-30% stanica već imalo neku mutaciju povezanu s nastankom raka kože iako su te osobe u trenutku blefaroplastike bile bez detektiranih kožnih promjena na vjeđama. Od te studije do danas pronađene su mnoge potencijalno patogene mutacije povezane s nastankom tumora u patohistološki naizgled zdravim tkivima. Treba imati na umu kako se naša tkiva mogu i spontano izboriti protiv takvih malignih klonova te nije nužno da svaki od ovih nalaza negdje u budućnosti rezultira tumorskom bolešću. Neke od novonastalih mutacija mogu odvesti stanicu u autodestrukciju što je u konačnici dobro za organizam.
Posebno su zanimljive mutacije u tkivima koja se rijetko ili uopće ne dijele, poput moždanog tkiva točnije neurona. Pokazalo se da su i u njima moguće mutacije koje nisu naslijeđene budući da su prisutne tek u manjem broju stanica mozga. One također nisu prisutne u ostalim tkivima što je ukazivalo da su nastale u nekom trenutku nakon što je organizam već poodmakao u diobama (jer bi inače bi bile prisutne u svim tkivima) ali dovoljno rano u razvoju organizma dok su se stanice mozga još dijelile. Drugi mogući način kako bi mogle nastati te ne-nasljedne mutacije u mozgu jest da su one rezultat oštećenja uslijed vanjskih čimbenika i da ta oštećenja nisu popravljena. Takve ne-nasljedne mutacije mogle bi biti u podlozi raznih psihijatrijskih stanja za koje ne postoji jasna nasljedna komponenta.
Neke su studije pokazale kako neuroni pedesetogodišnjaka mogu imati i do tisuću novonastalih mutacija. Nađene su i poveznice u nekim slučajevima autizma i shizofrenije, no kako je tkivo mozga naravno teško uzorkovati iz vrlo očitih razloga, takve studije su izrazito rijetke i mukotrpne. Amiotrofična lateralna skleroza (ALS) je podmukla i opaka bolest koja se može javiti u srednjoj životnoj dobi te osim jasnog nasljeđivanja nekog mutiranog gena unutar obitelji, može nastati i „iz vedra neba“ te je zanimljivo da u krvi takvih osoba nije nađena mutacija koja bi bila povezana s nastankom ove bolesti. Pokazalo se međutim da, iako mutacija nije nasljedna i stoga nije prisutna u krvi pojedinca, uzorci tkiva mozga i leđne moždine mogu imati prisutne mutacije povezane s ALS. Takve osobe su u stvari somatski mozaici i tkivo krvi nije reprezentativno za genetiku njihovog mozga. Ovo postaje osobito važno danas kada već postoje nove ciljane molekularne terapije koje su izrazito skupe, te genetika pojedinca igra glavnu ulogu u tome hoće li biti kandidati za takvo liječenje.
Prošle je godine američki NIH pokrenuo novi program istraživanja somatskog mozaicizma u tkivima čovjeka (Common Fund’s Somatic Mosaicism Across Human Tissues (SMaHT) Network) kako bi se ustanovilo koliko ima genetičke varijabilnosti u našim tjelesnim stanicama i tkivima. Za taj je program bilo alocirano oko 140 milijuna dolara. Prikupljat će se tkiva mozga, krvi, debelog crijeva, kože, jajnika, testisa i drugih tkiva u skupini od oko 150 ispitanika i tako će gotovo milijun dolara biti potrošeno na precizno mapiranje genoma svakog od njih. Naravno, nije to samo sebi svrhom već je ideja da se istraži kako taj proces nastanka somatskog mozaicizma funkcionira.
Kakav je vremenski tijek tog procesa, da li se on odvija istom brzinom tijekom života, usporava li ili ubrzava? Je li taj proces jednak u svim analiziranim tkivima ili postoje neke razlike? Naravno, ulagat će se i u metodologiju i tehnologiju potrebnu za ova istraživanja, a svako takvo ulaganje u konačnici znači i da će te tehnologije postati jeftinije i šire dostupne što će pokrenuti novi val istraživanja na globalnoj razini.
I na kraju, zašto bismo to istraživali? Možda je ovo ulaganje u znanost nekako lakše opravdati nego sekvenciranje genoma nekog opskurnog kukca ili ribice, ili nekog još fundamentalnijeg istraživanja pa mi je utoliko i lakše zaključiti ovaj tekst. Mnoge bolesti nisu nasljednog karaktera, dapače, smatra se kako je samo oko 10-20% neke patologije direktni rezultat nečega što smo naslijedili. Zatim dolazi indirektna nasljedna komponenta naše šire obitelji koja je presudnija za nekakvu početnu, možda malo povišenu sklonost obolijevanju, no nikako nije samoispunjujuće proročanstvo. Sve ostalo je na nama i našem životnom stilu. Najbolji primjer je možda nasljedna šećerna bolest nasuprot onoj koja se razvija uslijed neadekvatnog životnog stila. Drugi primjer su nasljedne tumorske bolesti s jasnom linijom nasljeđivanja kroz generacije u obitelji. Takvih je malo u odnosu na veliku većinu tumorskih bolesti koje nastaju kao rezultat štetnih utjecaja kroz život.
Jednadžba za bolest koja će nas dokrajčiti (ako izuzmemo infektivne bolesti, koje nas oportunistički dotuku kad su već sve karte odigrane) sastoji se od tri glavne komponente: onog što smo naslijedili, zatim onog što se događa s našom DNA zbog grešaka u diobama stanica, te vanjskih čimbenika koji oštećuju našu DNA. Mi tijekom života zapravo imamo šansu osvojiti dva životna jack-pota. Prvi je da se rodimo sa dobrim startnim genetskim pozicijama bez neke nasljedne otegotne okolnosti. Drugi jack-pot je da izbjegnemo sve „metke“ u vidu mutacija kojima smo izloženi zbog našeg vlastitog nesavršenog mehanizma umnažanja stanica ali i vanjskih čimbenika kojima smo izloženi. Stoga je za veliku većinu nas možda važnije od onog što smo naslijedili, ono što smo tijekom života od mutacija izbjegli. Oni kojima je sve ravno, rekli bi – od nečeg se mora umrijeti. Točno, ako te izbjegnu veliki metci poput tumora, kardioloških i neuroloških bolesti onda ćeš se jednostavno „dotrti“. No, upravo je taj dio kako do toga dolazi još uvijek nerazjašnjen. Kako to stanice s progresivnom akumulacijom mutacija koja nije dovela do nekog od ovih prethodnih stanja, ipak žive i kako se na kraju ipak ugase. Može li se ovaj proces usporiti ili preokrenuti? Već vidim sjaj u očima tehnomilijardera, stoga možda ovaj program NIH ipak izbjegne motornu pilu rezanja deficita, živi bili pa vidjeli.
1) Vijg J, Dong X. Pathogenic Mechanisms of Somatic Mutation and Genome Mosaicism in Aging. Cell. 2020;9;182(1):12-23. doi: 10.1016/j.cell.2020.06.024.
4) Martincorena I, Roshan A, Gerstung M, Ellis P, Van Loo P, McLaren S, Wedge DC, Fullam A, Alexandrov LB, Tubio JM, Stebbings L, Menzies A, Widaa S, Stratton MR, Jones PH, Campbell PJ. Tumor evolution. High burden and pervasive positive selection of somatic mutations in normal human skin. Science. 2015;22;348(6237):880-6. doi: 10.1126/science.aaa6806.
5) Lodato MA, Woodworth MB, Lee S, Evrony GD, Mehta BK, Karger A, Lee S, Chittenden TW, D’Gama AM, Cai X, Luquette LJ, Lee E, Park PJ, Walsh CA. Somatic mutation in single human neurons tracks developmental and transcriptional history. Science. 2015;2;350(6256):94-98. doi: 10.1126/science.aab1785