NOBELOVA NAGRADA ZA MEDICINU I FIZIOLOGIJU 2024.
MikroRNA. Otkriće novog mehanizma upravljanja genima
 Tamara Čačev / 9. listopada 2024. / Perspektive / čita se 8 minuta
Tamara Čačev / 9. listopada 2024. / Perspektive / čita se 8 minuta

 Tamara Čačev / 9. listopada 2024. / Perspektive / čita se 8 minuta
Tamara Čačev / 9. listopada 2024. / Perspektive / čita se 8 minuta

Ovogodišnji dobitnici Nobelove nagrade za medicinu ili fiziologiju, Ambros i Ruvkun, otkrićem mikroRNA otvorili su novo poglavlje u razumijevanju kako stanice koordinirano grade složene organizme, piše Tamara Čačev. Otkriće je od presudne važnosti za shvaćanje nastanka mnogih bolesti, ali i za razvoj novih terapija.
Vjerojatno jedna od najamblematskijih informacija koja vam je ostala u glavi sa satova biologije jest DNA→RNA→protein, nesretno nazvana još i centralnom dogmom molekularne biologije koju je 1958. godine postavio Francis Crick. Intencija ovog zapisa jest da pokaže smjer kojim genetička informacija teče od molekule DNA prema molekuli RNA koja zatim tu informaciju prenosi do mašinerije za sintezu proteina koji su izvršitelji raznih poslova u stanici i izvan nje. No, kako to obično biva, znanost napreduje i s vremenom su otkrivene iznimke od ovog pravila, iako načelno i dalje ova teorija vrijedi u velikom broju slučajeva. Stoga se termin dogma, osim zbog teološkog pristupa koji je sam po sebi nespojiv sa znanstvenim razmišljanjem, čini još neprikladnijim.
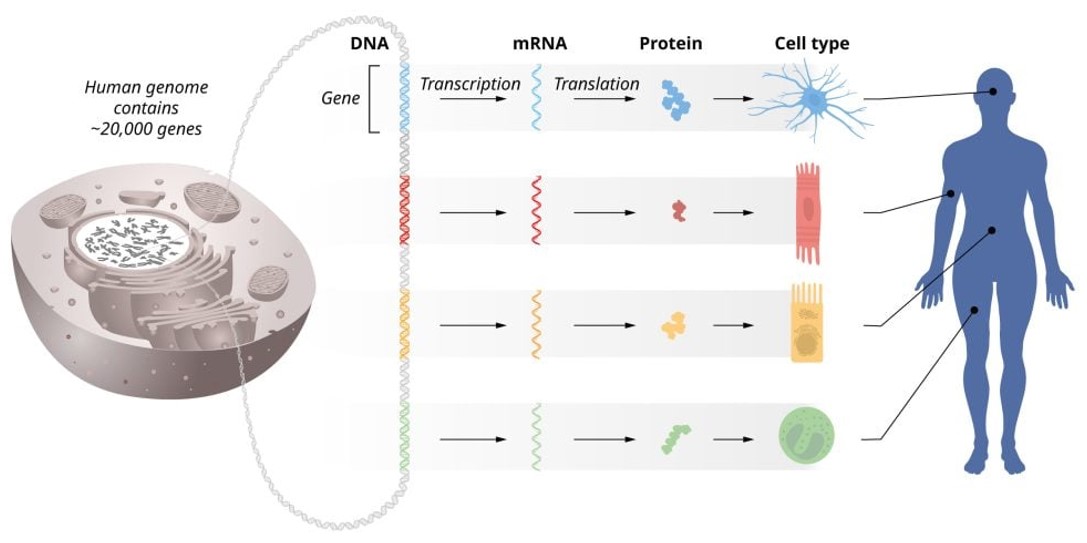
Iako bi se na temelju ovako postavljenog međuodnosa molekula DNA, RNA i proteina moglo zaključiti kako su molekule RNA tek nekakvi posrednici, svojevrsni glasnici koji šire informaciju po stanici (pa se stoga molekula mRNA naziva i glasničkom RNA), s vremenom se također pokazalo kako molekule RNA imaju i niz drugih također bitnih funkcija, između ostalog i u regulaciji ekspresije gena. Za to otkriće je ove godine i dodijeljena Nobelova nagrada za fiziologiju ili medicinu dvojici američkih znanstvenika Victoru Ambrosu i Garyu Ruvkunu koji su svoje znanstvene karijere započeli školovanjem i izradom doktorata na Massachusetts Institute of Technology (MIT) i Harvardu.
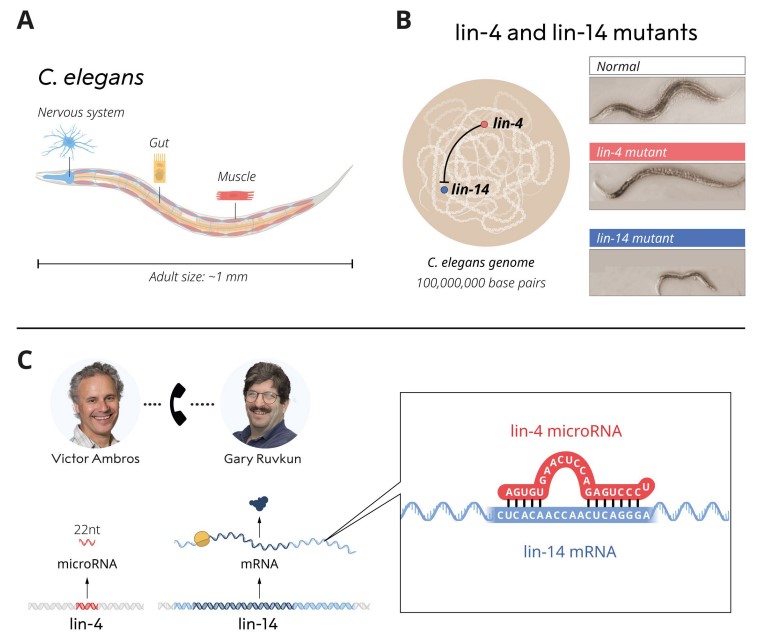
U prethodnom tekstu za Ideje osvrnula sam se na sposobnost stanica višestaničnog organizma da se unutar organizma točno vremenski i prostorno pozicioniraju upravo na mjestu koje je ispravno za obavljanje njihove funkcije. Kako bi se to postiglo potrebna je visoko sofisticirana regulacija ekspresije niza gena. Najosnovniji i najprije otkriven tip regulacije bio je onaj putem proteina nazvanih transkripcijski faktori koji se vežu na specifična mjesta na molekuli DNA te na taj način utječu na to da li će neki gen biti aktivan ili ne. Ovogodišnji laureati otkrili su drugi, također bitan način regulacije ekspresije gena, ali na razini nakon prepisivanja informacije iz DNA u mRNA (tzv. postranskripcijska regulacija). Oni su naime 1993. godine otkrili mikroRNA (miRNA), klasu molekula RNA koje ne prenose kodiranu informaciju kao molekule mRNA, pa se stoga svrstavaju u širu skupinu nekodirajućih RNA (engl. non-coding RNA).
Ambros i Ravkun bili su 80-tih postdoktorandi u grupi Roberta Horvitza. koji je također dobio Nobelovu nagradu 2002. godine za genetičku kontrolu procesa stanične diobe, diferencijacije i odumiranja tijekom razvoja organa, i bavili su se problemom pravovremene i sinkronizirane aktivacije niza gena koji će neku stanicu tijekom razvoja embrija usmjeriti u neki tip tkiva. Obje grupe, koje su kasnije osnovali, radile su na modelnom organizmu C. elegans, obliću koji je često korišteni model u istraživanjima procesa kojima se tkiva višestaničnih organizmama razvijaju u odrasli organizam. Zanimalo ih je kako se to dogodi da se stanice simultano „dogovore“ i koordinirano krenu u smjeru razvoja primjerice živčanog ili mišićnog tkiva točno na mjestu gdje je to potrebno. Razmislimo samo o našem organizmu, koliko koordiniranog djelovanja stanica treba da se bubreg nađe na mjestu gdje mora biti povezan sa nizom krvnih žila te da se u njemu nalazi gomila specifičnih stanica koje filtriraju različite vrste molekula ovisno o našem ukupnom trenutnom fiziološkom statusu. Jasno je da za izgraditi takav sustav treba vrlo komplesna koordinirana akcija koju još nismo uspijeli rekreirati u laboratoriju unatoč mnogim dosadašnjim pokušajima regenerativne biomedicine.
Krenuli su u dugotrajan i mukotrpan postupak kloniranja, tj. utvrđivanja točne sekvence i pozicije ovih genskih lokusa metodama koje se iz današnje perspektive čine pravim rudarenjem.
No, da se vratimo na otkriće vrijedno Nobelove nagrade. Dvojica znanstvenika i njihove grupe istraživali su dva specifična genska lokusa u genomu C. elegans lin-4 (Ambros) i lin-14 (Ruvkun). Ako su ovi lokusi mutirani, to rezultira nepravilnim razvojem oblića i to zbog nepravovremene aktivacije ‘programa’ koji usmjeravaju setove stanica u smjeru određene funkcionalne diferencijacije. Krenuli su u dugotrajan i mukotrpan postupak kloniranja, tj. utvrđivanja točne sekvence i pozicije ovih genskih lokusa metodama koje se iz današnje perspektive čine pravim rudarenjem. Nobelova nagrada se ne dijeli za trud i muku već za rezultat, no valja ovdje napomenuti kako bi cijeli postupak bio vjerojatno puno brži da su im današnje metode i tehnologije bile na raspolaganju.
Kada su ovi geni klonirani, došlo se do zanimljivog otkrića. Finalni produkt gena lin-4 nije bio neki funkcionalni protein, već nekodirajuća molekula RNA veličine 22 nukleotida (Ambros), dok je Ruvunova grupa pokazala kako lin-4 djeluje kao negativni regulator ekspresije genskog lokusa lin-14 pri čemu su ključnu ulogu imala mjesta na 3’UTR kraju lin-14. Ubrzo se ispostavilo kako postoji djelomična komplementarnost između lin-4 RNA te mjesta unutar 3’UTR regije lin-14. Stoga se nekodirajuća RNA lin-4 može vezati na lin-14 mRNA i na taj način blokirati da se informacija iz ove mRNA dalje prenese u sintezu proteina lin-14. Drugim riječima, iako je gen lin-14 aktivan i proizvodi mRNA lin-14 ona je blokirana u daljnjem procesu stvaranja proteina jer je na nju vezana komplementarna nekodirajuća RNA lin-4 (slika 2). Ovo zapravo predstavlja novi mehanizam regulacije aktivnosti gena koji se odvija nakon procesa transkripcije (stvaranja mRNA), a nekodirajuća RNA lin-4 smatra se prvootkrivenom u novoj funkcionalnoj klasi molekula RNA koju zovemo mikroRNA. Na ovom modelu je dakle po prvi puta pokazano kako ove mikroRNA imaju funkciju u regulaciji aktivnosti gena, a rezultati istraživanja ovih dvaju grupa objavljeni su u znanstvenom časopisu Cell u dva članka 1993. godine.
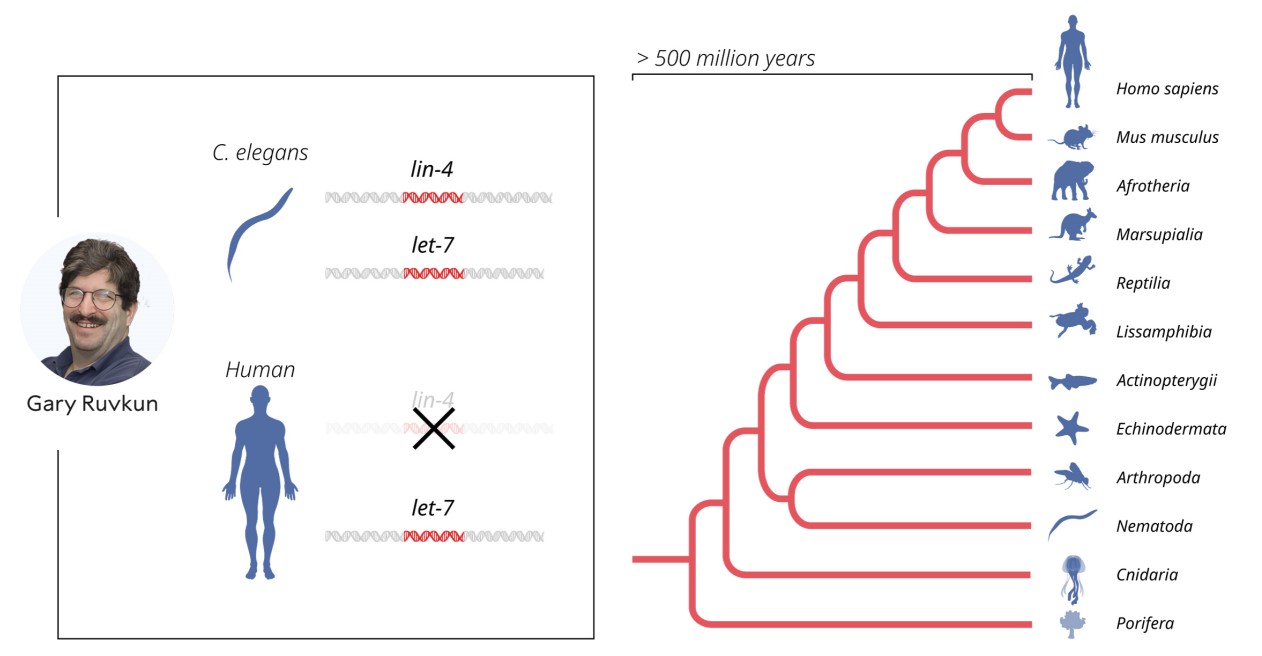
Odjek ovih istraživanja u prvo vrijeme nije bio velik budući da se ovaj tip regulacije aktivnosti gena smatrao „endemskim“ za C.elegans i vjerojatno neprimjenjivim za ostale višestanične organizme ili čovjeka. Zatim je Ruvkunova grupa 2000. godine otkrila još jednu mikroRNA let-7 za koju se pokazalo kako postoji u čitavom nizu drugih životinjskih organizama te je fokus znanstvene zajednice u čitavom svijetu usmjeren na pronalazak novih regulatornih mikroRNA i ubrzo se pokazalo kako postoji mnoštvo (zasad preko tisuću) ovakih molekula.
Danas znamo kako je ovaj mehanizam regulacije aktivnosti gena prilično raširen u životinjskom svijetu uključujući i čovjeka. Pokazalo se i kako su mehanizmi kao i mikroRNA koji u ovim procesima sudjeluju ostali vrlo sačuvani tijekom evolucije te da je ovaj tip regulacije gena bitan kako tijekom razvoja životinjskog organizma, tako i u odrasloj dobi. MikroRNA djeluju na zasad dva poznata načina: inhibiraju sintezu proteina kako je prethodno opisano ili vezanjem na mRNA izazivaju njeno usmjeravanje na degradaciju što opet rezultira izostankom sinteze proteina. Bitno je dodati kako jedna mikroRNA (misli se na tip, ne na količinu molekula) može regulirati ekspresiju niza gena. S drue strane, svaki gen može regulirati više različitih mikroRNA. Na taj način se i postiže koordinirano djelovanje čitavih setova gena koje je potrebno prilikom diferencijacije i usmjeravanja stanica u tkiva i organe.
Mnoge su se grupe zatim počele baviti ovim područjem te je otkriven način na koji se mikroRNA sintetiziraju. Danas se zna da nastaju iz veće primarne molekule (pri-mikroRNA) koja ima specifičnu strukturu poput ukosnice. Tu „ukosnicu“ prepoznaje kompleks proteina u kojima se nalazi i endonukleaza Drosha. Zatim se takvim procesiranjem dobije prekursorska mikroRNA (pre-mikroRNA) veličine 60-70 nukleotida. Daljnje procesiranje uključuje kompleks koji je bitan i za drugi vitalni proces u stanici a to je utišavanje RNA (RNA silencing, RNA intereference, RNAi). Dok je ovaj mehanizam prvenstveno u službi obrane stanice od virusnih infekcija te mobilnih elemenata u genomu, mikroRNA su zadužene za kontrolu ekspresije vlastitih gena, no to je još jedan od pokazatelja kompleksnosti mreže regulatornih mehanizama koji istovremeno djeluju u stanici.
Otkriće novog mehanizma regulacije aktivnosti gena bitno je za razumijevanje funkcioniranja i udruživanja stanica u tkiva te zatim organe sa specifičnim funkcijama u višestaničnom organizmu. Ako dođe do pogrešne aktivacije gena u krivom trenutku na krivom mjestu to može rezultirati različitim razvojnim oštećenjima koja su često nespojiva sa životom. Ako se pak ovi regulatorni mehanizmi poremete u odrasloj jedinki tada se stanice počinju ponašati neusklađeno s ostatkom organizma a ta neusklađenost vodi do niza bolesti poput nastanka tumora, šećerne bolesti ili autoimunih bolesti. Stoga je razumijevanje načina na koji se regulira aktivnost gena od presudne važnosti za shvaćanje kako mnoge bolesti nastaju, ali i za razvoj potencijalnih novih terapija.
1) Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993;75(5):843-854. doi:10.1016/0092-8674(93)90529-y
2) Wightman B, Ha I, Ruvkun G. Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell. 1993;75(5):855-862. doi:10.1016/0092-8674(93)90530-4
3) Pasquinelli AE, Reinhart BJ, Slack F, Martindale MQ, Kurodak MI, Maller B, Hayward DC, Ball EE, Degnan B, Müller P, Spring J, Srinvasan A, Fishman M, Finnerty J, Corbo J, Levine M, Leahy P, Davidson E, Ruvkun G. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA. Nature. 2000;408(6808):86-89. doi:10.1038/35040556