biologija
Molekule koje usporavaju starenje. Bezos i Google ulažu u istraživanje dugovječnosti
 Tamara Čačev / 28. siječnja 2022. / Članci / čita se 12 minuta
Tamara Čačev / 28. siječnja 2022. / Članci / čita se 12 minuta

 Tamara Čačev / 28. siječnja 2022. / Članci / čita se 12 minuta
Tamara Čačev / 28. siječnja 2022. / Članci / čita se 12 minuta

Nekolicina milijardera ulažu ogromne svote u produženje života. Tamara Čačev opisuje pristupe i perspektive, a posebno skreće pažnju na lijekove koji služe suzbijanju drugih bolesti a neočekivano se pokazuje da možda i usporavaju starenje
Nedavno se u medijima pojavila vijest kako je osnivač Amazona, Jeff Bezos, zajedno s Yuri Milnerom, još jednim tech milijarderom, investirao u istraživanje starenja i pronalaženje potencijalnih meta za razvoj anti-aging terapija biotehnološke tvrtke Altos Labs. Nije to čudno, i nije to prvi put da je to učinio, niti je on prvi tech milijarder kojeg starenje zanima sada kada je već debelo u srednjim godinama. Prije njega su to napravili i Googleovci kada su 2013. osnovali kompaniju Calico o kojoj se ni danas puno ne zna, a trebala bi se baviti starenjem i dugovječnošću. Tek je nedavno iz ove produkcije izašao preprint rada o reprogramiranju stanica, sa sličnom idejom koja je u temelju Altosa. Tu su još i AgeX Therapeutics, Shift Bioscience te Life Biosciences, a zlobnici bi rekli koliko kompanija, toliko otprilike i znanstvenih radova s kredibilnim utemeljenjem u području kojim se namjeravaju baviti. Osim vjerojatnog osobnog interesa bogataša, interes za ova istraživanja nije lišen ni filantropskih pobuda jer stanovništvo zapadnih razvijenih zemalja stari te tvori značajan segment društva (a naravno i tržišta) prema kojem će se ono morati oblikovati, a to je vjerojatno prvi takav trenutak u ljudskoj povijesti.
Proučavanje uzroka starenja, njegovo usporavanje ili reverzija u cilju pomlađivanja (ideja koja vjerojatno najviše pali investitore i predstavlja dobar sales pitch) sasvim su različite stvari. Bezosa i Milnera očito interesira ovo posljednje, pomlađivanje odnosno, ‘ufino kazano’, reprogramiranje stanica iz starih u mlade. Stoga su u i oko biotehnološke tvrtke Altos okupili respektabilne znanstvenike iz područja, poput dobitnika Nobelove nagrade, prof. Shinya Yamanaka. To ni ne čudi jer je ponuđena godišnja plaća za vrhunske znanstvenike od milijun dolara na više.

Nobelovac kojeg je angažirao Bezoz, Shinya Yamanaka (Wikimedia Commons)
No vratimo se Yamanaki, prema njegovom otkriću dovoljno je u tjelesne stanice unijeti svega nekoliko proteina (transkripcijskih faktora Sox2, Pou5f1 /Oct4/, Klf4, i Myc) kako bi se one reprogramirale iz diferenciranih u pluripotentne embrionalne matične stanice, dakle stanice nalik našim prvotnim stanicama iz kojih se zatim mogu ponovno dobiti različiti tipovi diferenciranih zrelih stanica. U takvim je eksperimentima sudjelovao i Dr. Izpisúa Belmonte, uključen i u Altosova istraživanja, a koji je na mišjem modelu pokazao kako je takvo reprogramiranje moguće. No, osim što su se neki miševi ‘pomladili’ mnogi su razvili i tumore što je jedna od predvidivih konsekvenci petljanja s nediferenciranim imortaliziranim stanicama (a to je zapravo školska definicija tumorskih stanica). Stoga veliki dio znanstvenika smatra da, prema sadašnjim spoznajama o reprogramiranju stanica, jedno teško može ići bez drugog te da je sve to vrlo daleko od ikakve praktične primjene ako se neće moći selektivno okidati samo proces pomlađivanja.
Drugi smjer istraživanja Altos Labsa je potraga za biomarkerima starenja, jer kako biste u realnom vremenu inače znali jeste li mlađi nego što biste trebali biti i je li neka anti-aging terapija djelovala. Pustimo one priče o dvadesetgodišnjacima zarobljenim u tijelu pedesetgodišnjaka ili parole „četrdesete su nove tridesete a pedesete nove četrdesete“. Dajte da to objektivno izmjerimo jer čekanje učinaka prirodnim slijedom događaja ipak bi predugo trajalo. U tom dijelu istraživanja angažiran je Dr. Steve Horvath koji se prethodno bavio upravo ‘biološkim satovima’, odnosno molekularnim mehanizmima pomoću kojih stanice ‘osjećaju’ protok vremena. Ideja jest da bi se uz primjenu nekog takvog pouzdanog biomarkera mogao utvrditi početni i ishodišni status organizma te objektivno procijeniti je li postignut anti-aging učinak. Bit će to vjerojatno jednako rudarski pothvat kao i temeljno usmjerenje istraživanja jer znamo da nažalost nismo previše postigli ni u pronalaženju biomarkera kao specifičnih ranih pokazatelja pojave bolesti gdje bi to bilo izrazito bitno, poput neurodegenerativnih bolesti ili tumora.
No, zašto starimo? Svi procesi u prirodi teže entropiji a živa bića kao uređeni skup biokemijskih procesa se tome neko vrijeme odupiru uz popriličan trošak energije. Zato i moramo svaki dan unijeti određenu količinu kalorija, što nam mnogima ne pada teško, kako bismo imali dovoljno energije za održavanje kontra entropije. No, kao nusprodukti metaboličkih procesa i oslobađanja energije nastaju molekule koje oštećuju proteine i DNA u stanici. Uz ove intrinzičke uzročnike oštećenja, vanjski okoliš kao i naš životni stil (pušenje, izlaganje UV zrakama, pretilost i slično) doprinose ukupnosti oštećenja naših stanica. Postoje mehanizmi koji ova oštećenja popravljaju ali oni nisu svemogući te naše stanice s vremenom nakupljaju oštećenja i stare. Taj se proces možda najjasnije vidi na koži. Primjerice ako usporedimo kožu novorođenčeta s kožom osamdesetogodišnjaka, rezultat ovih procesa jest opuštenost i naboranost tkiva kao i hiperpigmentacije te različite izrasline. No to što je tako jasno vidljivo na koži, događa se i u ostatku našeg organizma. U svojem zadnjem pismu dioničarima 2020.g. Bezos se očito vodio razmišljanjima o entropiji i živim bićima ali i društvu i vlastitoj tvrtki te je uključio i citat iz knjige R. Dawkinsa Slijepi urar: “Staving off death is a thing that you have to work at…If living things don’t actively work to prevent it, they would eventually merge with their surroundings and cease to exist as autonomous beings. That is what happens when they die.” Reklo bi se, ništa novog što nam fizičari već nisu davno otkrili, no eto valjda trebaju i Dawkins i Bezos da to poguraju u kolektivni mainstream.
Kada neka stanica postane toliko oštećena da više nije funkcionalna postoje mehanizmi kojima ih organizam programirano ubija, no dio takvih stanica biva ‘uspavan’ i prestaje se dijeliti te u takvom statusu perzistira u organizmu. Te se tzv. senescentne stanice s vremenom nakupljaju u organizmu i to ponajprije u koži, jetri, plućima i slezeni, no s vremenom se otkrivaju u gotovo svim našim tkivima. Nekad se smatralo kako takve stanice, iako ne bivaju uklonjene, ne predstavljaju neki problem, no danas znamo kako one nisu ni približno toliko inertne kako se smatralo, te da su značajan izvor signalnih molekula koje mogu poremetiti normalno funkcioniranje zdravog tkiva i tako pridonositi starenju i nastanku bolesti koje u podlozi imaju kroničnu upalu, a to su gotovo sve bolesti modernog doba, od kardiovaskularnih do neurodegenerativnih i tumorskih bolesti. Eksperimenti na miševima su pokazali da ako uklonimo senescentne stanice dolazi do svojevrsnog usporavanja njihovog starenja. Možda je stoga realističnije od reprogramiranja i pomlađivanja pokušati donekle ovladati procesima starenja, barem u segmentima gdje su oni povezani s oštećenjima koja vode u neurodegenerativne bolesti i rak pa ako se pri tome postigne i mladenački izgled, okretnost i dugovječnost još i bolje.
Starenje je proces koji oduvijek zaokuplja ljude i svi bismo ga najradije ako već ne preokrenuli ili zaustavili a onda barem usporili. Pretpostavljam kako priličan broj ljudi razmišlja o starenju kao nekakvom unificiranom procesu propadanja koji je kod svih nas više manje isti. Stoga je i jedan od naslova vezan uz vijest o Bezosu bio da je investirao u lijek za starenje. To vam je otprilike isto kao da kažete da je investirao u lijek za rak, jer kao što ni rak nije jedinstvena bolest to nije ni starenje i zapravo se radi o čitavom spletu različitih metaboličkih i fizioloških procesa koji vode ka istom konačnom ishodu. Stoga se upravo u toj velikoj mreži mogućih puteva i krije mogućnost da se kod nekoga on odvija uvjetno rečeno brže a kod nekog sporije. Postavljeno je niz hipoteza o procesu starenja koje se ugrubo mogu podijeliti na to da se radi o programiranom shut-down procesu koji je kodiran svojstvima naše DNA te na drugoj strani da se radi o progresivnoj akumulaciji oštećenja. I naravno niz hibridnih teorija, jer je istina nekako uvijek negdje u sredini. Jedna od prvih koja je bila potkrijepljena na molekularnoj razini bila je ona o skraćivanju telomera (krajeva kromosoma) tijekom dioba stanica te kada one postanu prekratke slijedi smrt ili senescencija stanice. No danas nismo više sigurni je li ovaj proces uzročnik ili samo jedna od manifestacija starenja. Činjenica jest da je u tumorskim stanicama ovaj proces zaustavljen te da su one na staničnoj razini zapravo besmrtne (druga je stvar što ubiju svojeg domaćina pa na kraju i one nestanu). No, skraćivanje telomera nije ni približno jedina promjena koja tumorskim stanicama omogućava tu uvjetnu besmrtnost.
Kako se radi o procesima na razini stanice jasno je da su velika očekivanja upravo od istraživanja humanog genoma. Za Ideje sam pisala o tzv. plavim zonama odnosno regijama u svijetu gdje živi najviše stogodišnjaka. Antropolozi su naravno napravili svoja istraživanja, sekvencirana je i DNA stogodišnjaka, no nije se došlo do nekog čudesnog eliksira mladosti odnosno gena za koje bismo mogli tvrditi da su upravo oni odgovorni za činjenicu da je ta osoba doživjela duboku starost. Stoga se došlo na ideju da se možda ne radi o tome da ti stogodišnjaci ‘imaju’ nešto bitno u svom genomu, nego je možda upravo stvar u tome da nešto ‘nemaju’ odnosno da su oni zapravo dobitnici životne lutrije jer su naprosto tijekom života uspjeli izbjeći svaki metak (oštećenje) koji bi izazvao bolest. No, ni oni nisu besmrtni, samo su možda malo bolje sreće pa se dulje odupiru. I tako dolazimo do druge bitne činjenice vezene uz starenje, a to je da ne starimo svi jednakom brzinom. Sigurno poznajete neke ljude koji su u dubokoj starosti izrazito bistra uma i funkcionalni, kao i nažalost neke koji starost zbog bolesti nisu uspjeli dočekati. U ljudskoj vrsti postoji neka gornja granica trajanja života, ali je možda još nismo dosegnuli, iako smo u dvadesetom stoljeću napravili značajne iskorake zahvaljujući enormnom napretku medicine. Nismo ni približno najdugovječnija živa bića na planetu, obično kada razmišljamo o tome usmjereni smo na papige, kornjače i slično, no ako se okrenemo ka biljnom svijetu, nije rijetkost da neka maslina, hrast ili lipa žive i po nekoliko stotina godina, a radi se o prilično kompleksnim organizmima koji su izloženi vanjskim i unutarnjim čimbenicima gotovo kao i ljudi.
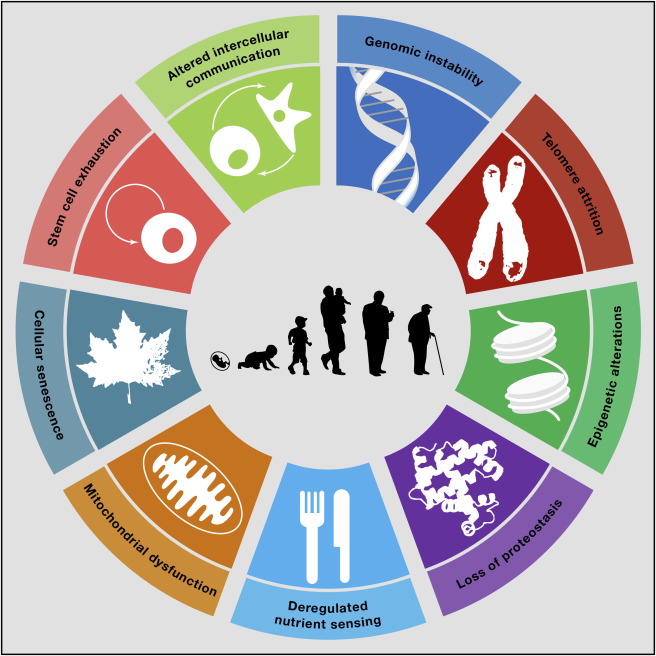
Kako smo rekli da u procesima starenja sudjeluje čitava mreža signalnih puteva i metaboličkih procesa, to otvara mogućnosti za niz meta koje bi se mogle inhibirati ili aktivirati ciljanim molekulama. Analogno slavnom radu Hanahana i Weinberga o glavnim obilježjima tumorskih stanica, spoznaje o molekularnim promjenama koje se nalaze u temeljnim procesima starenja pokušale su se ujediniti u radu The hallmarks of aging. Sukus je rada da su ključni elementi u procesu starenja nestabilnost genoma, skraćivanje telomera, epigenetske promjene, gubitak sposobnosti razgradnje proteina, poremećaji u ‘osjećanju’ nutrijenata, poremećaj rada mitohondrija kao elektrane koja proizvodi energiju u stanicama, senescencija, iscrpljivanje bazena matičnih stanica iz kojih se tkiva poput crijeva ili kože obnavljaju, te općenito poremećaji u komunikaciji stanica (slika 1).
Kako se radi o nizu staničnih procesa uključenih u starenje, neki lijekovi koji su već u primjeni zbog drugih patologija, poput metformina koji se koristi u liječenju šećerne bolesti i rapamicina, pokazali su i neočekivana anti-aging svojstva. O tome je li taj učinak stvaran i prisutan kod ljudi te koji su molekularni mehanizmi u pitanju još uvijek nije postignut konsenzus zbog njihovog panstaničnog utjecaja na čitav niz procesa u stanici.
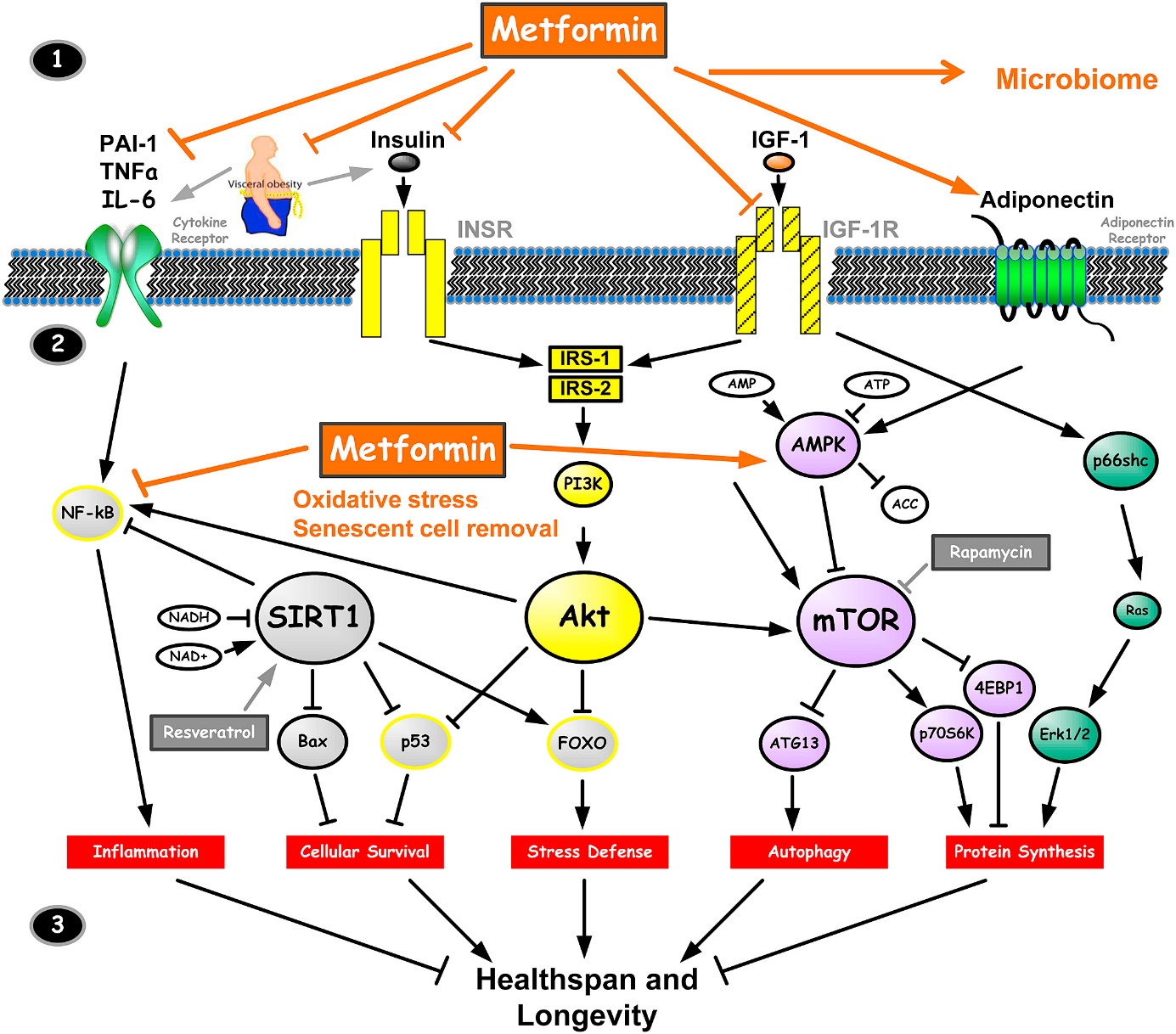
No, interesantno je kako priličan broj već poznatih supstanci s potencijalnom anti-aging primjenom između ostalog zadiru i u energetski balans stanice. Ideja je da one simuliraju učinak kalorijske restrikcije kojom se smanjuje sagorijevanje energije u stanicama pa teoretski i količina oštećenja nastalih kao nus produkt tog sagorijevanja. Dodatno se ‘izgladnjivanjem’ stanica aktiviraju i mehanizmi regeneracije koji su također bitni za funkciju tkiva. U skladu s važnosti energetskog statusa za dugovječnost je i opažanje kako veće i hladnokrvnije životinje, niže razine metabolizma načelno dulje žive. Znamo da se (bio)kemijski procesi ubrzavaju i usporavaju ovisno o temperaturi te stoga možda ni fikcionalne ideje o zamrzavanju i oživljavanju u nekom drugom vremenu nisu bile baš bez ikakvih osnova. Kad smo već kod fikcije i mitova čitavo usmjerenje vampirskih knjiga i filmova temelji se na krvi kao osnovi pomlađivanja. I koliko se god se to činilo naivnim nabadanjem, pokazalo se da čimbenici iz krvne plazme, faktori rasta i regeneracije, mogu biti korisni (barem u ranim fazama starenja tkiva i relativno kratkotrajnog učinka) u estetskoj dermatologiji ali i nekim drugim sferama primjene gdje se očekuje ubrzavanje procesa regeneracije tkiva.
Vratimo se drugoj spominjanoj anti-age molekuli – rapamicinu. Njegova primarna primjena je u oblaganju stentova i sprečavanju odbacivanja transplantata no pokazalo se kako ima i protuupalna i antitumorska svojstva. Pretpostavlja se kako bi njegov učinak u prevenciji starenja bio temeljen na tome da inhibira protein mTOR koji pak regulira produkciju proteina u stanici. Kada bi produkcija proteina bila inhibirana onda bi stanica morala reciklirati postojeće oštećene proteine umjesto da se oni nakupljaju u stanici. Energetski je za stanicu manji trošak stalno proizvoditi nove proteine nego reciklirati stare te se u uvjetima bez intervencije upravo to i događa. No nakupljanje proteina šteti stanici i proizvodi niz učinaka koji su u osnovi starenja. Interesantno je kako i jedan od krakova djelovanja metformina (slika 2) posredno opet vodi ka ovoj grani signalinga putem mTOR.
Osim ovih postojećih supstanci, postoji čitav niz tzv. senolitika u različitim fazama istraživanja a čija bi primjena imala uništiti ili modificirati senescentne stanice u organizmu te je ideja da bi se kombiniranim djelovanjem moglo postići produljenje života. U idućim dekadama sigurno će doći do značajnijih iskoraka i u ovom području te se stoga nadajmo da ćemo barem toliko poživjeti da neke od njih i isprobamo.