GENETSKI INŽENJERING - ETIČKE DILEME
Što je CRISPR-Cas9 sustav za prepravljanje genoma o kojem raspravlja cijeli znanstveni svijet
 Marko Močibob / 11. kolovoza 2017. / Perspektive / čita se 14 minuta
Marko Močibob / 11. kolovoza 2017. / Perspektive / čita se 14 minuta

 Marko Močibob / 11. kolovoza 2017. / Perspektive / čita se 14 minuta
Marko Močibob / 11. kolovoza 2017. / Perspektive / čita se 14 minuta

Otkrićem sustava CRISPR-Cas9 dobili smo oruđe koje omogućuje zahvate u genome živih bića dosad neviđenom preciznošću i lakoćom. Dok je korist CRISPR-Cas9 tehnologije za istraživačke svrhe nemjerljiva i neupitna, koliki će biti utjecaj na ljudsku svakodnevnicu, hoće li zaživjeti u kliničkoj primjeni i hoće otvoriti vrata prepravljanju ljudskog genoma i u konačnici ljudske vrste?
Od pradavnih vremena ljudi nastoje utjecati na svijet oko sebe, uključujući i žive organizme kojima smo okruženi. U početku su promjene bile polagane, postupne, ograničene na probir prirodnih ili slučajnih varijanti metodama umjetne selekcije i ciljanog križanja. Rezultati su svejedno bili dramatični (slika 1). U dvadesetom stoljeću zakoni nasljeđivanja, geni, mutacije i sl. dobili su svoju materijalnu osnovu otkrićem uloge i strukture DNA. Početak “pravog” genetičkog inženjerstva – ciljane izmjene, spajanja i prekrajanja molekula DNA možemo smjestiti u sedamdesete godine XX. stoljeća, kada su otkrivene restrikcijske endonukleaze, DNA-ligaze i ostali enzimi – glavna oruđa molekularne biologije.
Restrikcijske endonukleaze, DNA-ligaze i prateći enzimi postali su “škare” i “ljepilo” molekularnih biologa koji su omogućili spajanje DNA iz različitih izvora i organizama u laboratoriju, u epruveti. Takvu rekombinantnu DNA moguće je vratiti natrag u bakteriju, i “preprogramirati” je željenim genom ili stranom DNA. Na takav način danas dobijamo rekombinantni inzulin i hormon rasta (somatotropin: hGH) i mnoge druge korisne lijekove. Osim toga, npr. inzulin koji se danas koristi dodatno je izmijenjen i poboljšan genetičkim inženjerstvom, i nije istovjetan prirodnom ljudskom inzulinu.

No, genetski inženjering bakterija ili genetski inženjering biljaka i životinja su bitno različiti. Zbog brojnih tehničkih razloga, genetski inženjering biljaka i životinja je znatno teži i kompliciraniji. Na fundamentalnoj bazi, genomi biljaka i životinja su znatno veći od genoma bakterija. Ljudski genom je ugrubo 1000 puta veći od bakterijskih genoma, dok su genomi biljaka još i veći. Struktura genoma je kod biljaka i životinja znatno složenija, kao i mehanizmi regulacije aktivnosti gena. Metode genetskog inženjeringa životinja (prvenstveno miševa) i biljaka počele su se razvijati vrlo brzo i paralelno s genetičkim inženjerstvom mikroorganizama, ali ostala je zahtjevna i elitna disciplina. Unatoč tome, genetički inženjering biljaka i životinja transformirao je svijet u kojem živimo: genetički modificirani (GM) usjevi su naša svakodnevnica i izvor mnogih prijepora, a transgenični miševi, štakori, i ostali GM modelni organizmi odigrali su nezamjenjivu i nemjerljivu ulogu u napretku biomedicine.
No, osim “ubacivanja” stranih gena u željeni organizam (transgenični organizmi) i “izbacivanja” gena iz funkcije (knock-out gena), ukazala se velika potreba i za editiranjem genoma – izmjenama, prekrajanjem, prepravljanjem genoma (eng. genome editing). Granice između pojmova poput genetičkog inženjeringa, editiranja genoma, genetičkih modifikacija i sl. tanke su i u velikoj mjeri se preklapaju. Strogo gledano, editiranje ili prepravljanje genoma je samo podvrsta genetičkog inženjeringa ili genetičkih modifikacija. Za potrebe ovog teksta pojednostavnimo da su prijašnje metode genetičkog inženjerstva oslanjale se na ubacivanje strane DNA u ciljni organizam ili dokidanje postojećih gena, dok metode editiranja ili prepravljanja genoma omogućavaju sofisticiranije, preciznije i ciljane izmjene unutar gena ili genoma.
Takva tehnologija prepravljanja genoma postojala je i prije sustava CRISPR-Cas9. Prva inkarnacija takve tehnologije bile su nukleaze s cinkovim prstima (eng. ZNF; zinc-finger nucleases), a zatim TALEN (eng. transcription activator–like effector nucleases). To su bili proteini koji su imali modul za prepoznavaje željenog mjesta na DNA i modul za cijepanje DNA, nakon vezanja na željno mjesto (lokus). Problem je bio što je razvoj i optimizacija modula za prepoznavanje željenog mjesta DNA bio spor i mukotrpan postupak, s brojnim zamkama, pa je njihova primjena bila daleko od rutinske i jednostavne.
Na scenu 2012. godine stupa sustav CRISPR-Cas9, koji je do temelja potresao područje prepravljanja genoma, a samim time i cijelo područje molekularne biologije i biomedicine. Radi se o sustavu koji je s jedne strane programabilan, lako prilagodljiv s obzirom na “metu”, a s druge strane primjenjiv na najrazličitije modelne organizme, od biljaka, životinja, pa sve do humanih stanica i ljudskih embrija. U zaista kratko vrijeme od svega 5 godina tehnologija bazirana na CRISPR-Cas9 doživjela je brojne primjene i varijacije, te je svojom jednostavnošću i pristupačnošću otvorila vrata (ili Pandorinu kutiju) prepravljana genoma praktički svima.
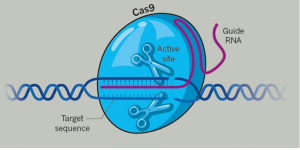
Sustav CRISPR-Cas9 sastoji se od dvije komponente: proteina – enzima Cas9 koji cijepa molekulu DNA i male molekule RNA koja navodi Cas9 na njegovu metu, željeno mjesto na DNA gdje želimo napraviti promjenu na genomu, odnosno mjesto prepravljanja genoma (slika 2). Na mjesto loma molekule DNA regrutiraju se različiti stanični čuvari genetskog koda – proteini koji sudjeluju u popravku DNA, a koji se mogu usmjeriti da poprave određenu mutaciju, onesposobe određeni gen ili ubace dodatne slijedove nukleotida u DNA.
Za razliku od prijašnjih tehnologija poput nukleaza s cinkovim prstima ili TALEN-a koje se oslanjaju na prepoznavanje određenog mjesta u genomu interakcijom proteina s DNA, pravila prepoznavanja RNA i DNA su daleko jednostavnija i dobro poznata, i puno lakša za predvidjeti. Time smo dobili modularan, programabilan sustav koji je jednostavno usmjeriti ili preusmjeriti na određeno mjesto u genomu mijenjanjem RNA koja ga tamo usmjerava, prema dobro poznatim Watson-Crickovim pravilima sparivanja nukleotida.
Doista, umjesto razvoja alata potrebnog za riješavanje određenog problema, dobili smo sustav koji je vrlo sličan današnjim računalima: učitavanjem novog programa, računalo dobija novu namjenu. Postupci prepravljanja genoma za koje su bili potrebni mjeseci i godine, sada se se mogu napraviti u nekoliko tjedana, uz zamjetno niže troškove. Zbog svoje modularnosti i programabilnosti, dovoljno je samo upotrijebiti drugačiji fragment RNA, dok su ostale komponente i reagensi dostupni “s police”, bez dodatnih troškova. Jednostavnost, dostupnost i niski troškovi demokratizirali su područje prekrajanja genoma i učinili ga dostupnim praktički svima zainteresiranima (link).
Otkud potječe tehnologija CRISPR-Cas9? Zanimljivo je da je tehnologija nastala iz sasvim druge, nepovezane linije istraživanja. CRISPR je skraćenica za clustered regularly interspaced palindromic repeats, a otkriveni su kod bakterija još 1987. godine. CRISPR su mjesta unutar genoma bakterija i povezani su s bakterijskom obranom od virusa koji ih napadaju. Mali komadi virusne DNA ugrađuju se i čuvaju unutar CRISPR i na taj način bakterija “pamti” kojim virusima je bila izložena i koji virusi su je prije napali. Informacija unutar CRISPR prepisuje se u RNA koji na sebe veže protein Cas9 i stalno nadzire i provjerava je li DNA na koju Cas9 nailazi njoj slična, tj. radi li se o virusnoj DNA. Ukoliko Cas9 naoružan s RNA iz CRISPR-a prepozna da se radi o virusnoj DNA, pocijepat će je i obraniti bakteriju od napada virusa.
Prema tome, radi se o svojevrsnom mehanizmu adaptivne imunosti kod bakterija koja omogućuje bakterijama da “pamte” viruse koje su prije susrele i preživjele. Jennifer Doudna i suradnici prepoznali su i pokazali 2012. godine da se protein Cas9 može iskoristiti za cijepanje DNA na točno određenom, ciljanom mjestu u živoj stanici i time pokrenuli tektonske promjene u području genetičkog inženjerstva čiji se razmjeri tek naslućuju. Važno je istaknuti da su istaživanja CRISPR-Cas9 bila potpuno fundamentalnog značaja, a u konačnici su dovela do tehnologije s neslućenim mogućnostima primjene.
Od otkrića 2012. do kraja 2014. godine, CRISPR-Cas9 je bio upotrebljen u prekrajanju genoma humanih stanica (u staničnoj kulturi), modelnih organizama poput miša, štakora, vinske mušice, žabe, guštera, biljaka poput riže, pšenice i duhana, kvasca Kluyveromyces, itd. Već 2015. godine kineski znanstvenici upotrijebili su CRISPR-Cas9 za prekrajanje genoma ljudskog embrija
Sustav temeljen na CRISPR-Cas9 pokazao se fleksibilnim i primjenjivim na brojne modelne organizme i probleme, što je zapravno rijetkost u polju molekularne biologije. Zbog složenosti genetičkog inženjeringa biljaka i životinja, alati i trikovi koji se koriste za npr. genetički inženjering miševa nisu nužno primjenjivi u vinskoj mušici ili obliću Caenorhabditis elegans. Od otkrića 2012. kao alata za prepravljanje genoma do kraja 2014. godine, CRISPR-Cas9 je bio upotrebljen u prekrajanju genoma humanih stanica (u staničnoj kulturi), modelnih organizama poput miša, štakora, vinske mušice, žabe, guštera, biljaka poput riže, pšenice i duhana, kvasca Kluyveromyces, itd. (slika 3). Već 2015. godine kineski znanstvenici upotrijebili su CRISPR-Cas9 za prekrajanje genoma ljudskog embrija. Time su pokazali da je u principu moguće uvesti nasljedne promjene u ljudski genom pomoću tehnologije CRISPR-Cas9, iako su za svoja istraživanja upotrijebili nevijabilne embrije koji se ne mogu razviti u živo novorođenče.

Razvijene su i brojne varijacije sustava CRISPR-Cas9 koje služe u druge svrhe povrh prepravljanja genoma. Već je objašnjeno da se sustav sastoji od “škara” koje režu DNA – proteina Cas9, i RNA za navođenje škara na njihovu metu. Ako “pokvarimo škare”, na način da mutiramo protein Cas9 i onesposobimo ga za cijepanje DNA, dobili smo varijantu koja se još uvijek može čvrsto vezati na točno određeno mjesto u genomu. To je izrazito korisno za ciljano aktivirati ili deaktivirati određene gene u genomu. Svojim vezanjem na gen takve “pokvarene škare” blokiraju njegovu aktivnost, a ako na “pokvarene škare” prikačimo module za aktivaciju gena, možemo potaknuti aktivnost gena koji se nalaze u blizini tog mjesta.
Potencijalne primjene CRISPR-Cas9 su neslućene i kontroverzne. Najviše prijepora naravno izaziva primjena te tehnologije na ljudima, pri čemu valja razlikovati dva tipa primjene, dvije vrste genetskih modifikacija: prepravljanje genoma somatskih stanica kod odraslih ljudi koje nisu nasljedne, i editiranje genoma embrionalnih stanica koje se mogu prenijeti na buduće naraštaje.
Editiranje genoma somatskih stanica koje se ne prenosi na potomstvo je bliska i vrlo izvjesna budućnost. Iako nesumnjivo izaziva osjećaj neugode kod mnogih ljudi, ne očekuje se znatan otpor javnosti s obzirom na moguću dobrobit. Npr. tehnologijom CRISPR-Cas9 moguće je inaktivirati DNA HIV-a i ukloniti virusnu DNA iz kromosoma zaraženih stanica, te spriječiti daljnju zarazu i napredak infekcije HIV-om u organizmu. U SAD je 2016. godine odobrena je klinička studija koja obuhvaća prepravljanje genoma T-stanica, koje su dio imunološkog sustava, u svrhu borbe protiv tumora. U kliničkoj studiji je previđeno uzimanje T-stanica iz pacijenta, prepravljanje njihovog genoma pomoću CRISPR-Cas9, s ciljem da učinkovitije prepoznaju i razaraju stanice tumora kada se vrate u organizam pacijenta.
Sličan postupak odobren je i u Kini 2016. godine u sklopu kliničke studije liječenja tumora pluća. Takav tip terapije gdje je moguće izdvojiti stanice iz organizma pacijenta, editirati njihov genom, te “izliječene” ili “poboljšane” stanice vratiti natrag u organizam je najizglednije da će prvi ući u praksu. Direktna genska terapija tkiva ili cijelog organizma je manje izgledna u bliskoj budućnosti jer je teško postići ulazak komponenti CRISPR-Cas9 u sve ili u znatan broj stanica nedirnutog tkiva unutar organizma. Tu su naravno i nasljedne bolesti. Poznato je preko 10 000 monogenetskih nasljednih bolesti, a preko 3 000 njih uzrokovano je točkastim mutacijama, što znači da bi bilo relativno jednostavno popraviti ih editiranjem genoma.
Pandorina kutija otvorena je prepravljanjem genoma embrionalnih stanica s ciljem popravljanja, odnosno spriječavanja genetskih bolesti. U tom slučaju promjenu nasljeđuju sve stanice u odraslom organizmu, ali promjene se prenose i na buduće naraštaje. U konačnici, promjenu ne nasljeđuje samo jedna individua, već se s vremenom širi u cijeloj ljudskoj populaciji.
Prvi takav zahvat napravili su kineski znanstvenici 2015. godine na nevijabilnim embrijima. U kolovozu 2017. godine objavljeno je da su američki znanstvenici uspjeli popraviti defektan gen u embriju čovjeka koji je povezan s abnormalnim povećanjem i nenadanim zatajenjem srca. Zbog dalekosežnih implikacija takvi postupci nisu još dozvoljeni u kliničkoj praksi. U prosincu 2015. godine u Washingtonu je održan međunarodni sastanak najeminentnijih znanstvenika u polju, na kojem je zaključeno da se treba suzdržati od prepravljanja genoma embrionalnih stanica sve dok u potpunosti ne budu sagledana pitanja sigurnosti, učinkovitosti, mogućih rizika i dobrobiti takvih postupaka, i ne postigne se širi društveni konsenzus oko njihove primjenjivosti i prikladnosti, te isključivo pod strogim nadzorom regulatora.
U početku će se tehnologija koristiti za spriječavanje teških nasljednih bolesti, zatim za korekcije nepoželjnih osobina ili lakših defekata, a u konačnici će biti teško oduprijeti se unaprijeđivanju ili poboljšanju ljudskih osobina kako tehnologija bude sve šire prihvaćena i rutinizirana. Budući da će uvedene promjene genoma biti nasljedne i prenositi se na buduće naraštaje, utjecat će u konačnici na razvoj cijelokupne ljudske rase
Iako zaključci tog sastanka nemaju zakonodavnu ili legalnu težinu, donesene smjernice imaju jak utjecaj na znanstvenu zajednicu, regulatorna tijela i buduću zakonsku praksu. No, jednom kada editiranje genoma embrionalnih stanica uđe u kliničku praksu, bit će teško ograničiti njegovu primjenu. Tada će pojava “dizajnerskih beba” ili ljudskih jedinki odabranih, unaprijeđenih i poboljšanih svojstava postati samo pitanje vremena: u početku će se tehnologija koristiti za spriječavanje teških nasljednih bolesti, zatim za korekcije nepoželjnih osobina ili lakših defekata, a u konačnici će biti teško oduprijeti se unaprijeđivanju ili poboljšanju ljudskih osobina kako tehnologija bude sve šire prihvaćena i rutinizirana. Budući da će uvedene promjene genoma biti nasljedne i prenositi se na buduće naraštaje, utjecat će u konačnici na razvoj cijelokupne ljudske rase.
Sljedeće polje koje će CRISPR-Cas9 prodrmati je hrana, GM usjevi i GM životinje (link). Prije razvoja tehnologija editiranja genoma, genetska modifikacija biljaka odvijala se ubacivanjem željenih gena na nasumične, slučajne položaje u genomu, zajedno sa sekvencama iz bakterija, virusa ili drugih organizama potrebnih da gen bude aktivan. Sam postupak je relativno neučinkovit, te izaziva strahove i sumnje javnosti zbog prisutnosti stranih gena u biljci. Osim samog postupka genetske modifikacije, i zakonska regulativa GM biljaka je vrlo skupa i kompleksna, zbog čega se na tržištu nalaze samo GM biljke od velikog ekonomskog interesa, poput kukuruza i soje.
Sustav prepravljanja genoma biljaka ili životinja pomoću CRISPR-Cas9 tu dodatno komplicira stvari: sustav CRISPR-Cas9 omogućava prepravljanje postojećih slijedova DNA u ciljnom organizmu, bez umetanja strane DNA, i bez ostavljanja “molekularnih ožiljaka”, odnosno tragova izmjene genoma. Zbog svoje točnosti i preciznosti u mijenjanju postojećih slijedova DNA u genomu, bez umetanja strane DNA kao kod transgeničnih biljaka, takve organizme bilo bi teško prepoznati jednom kada dospiju na tržište. Male, precizne promjene u genomu kakve omogućuje CRISPR-Cas9 bilo bi nemoguće razlikovati od slučajnih, prirodnih mutacija ili promjena dobijenim klasičnim oplemenjivanjem biljaka. Ako nema umetanja strane DNA, nema zapravo načina da se izmijenjeni proizvod – biljka ili životinja prepravljenog genoma detektira i prati u proizvodnom lancu, a mnoge primjedbe na GM ili transgenične biljke biti će neutemeljene. Zbog specifičnosti izazova, tek treba razviti zakonsku regulativu upotrebe i uzgoja biljaka i životinja prepravljenog genoma.
Duh CRISPR-Cas9 je pušten iz boce i već je promijenio istraživanja s područja molekularne biologije i biomedicine. Znanstvena zajednica dobila je moćno oruđe koje je učinilo polje prepravljanja genoma široko dostupnim svima; povratka nema. Razvoj i demonstrirane primjene te relativno mlade tehnologije unatrag samo 5 godina su fascinantne. I dok je korist CRISPR-Cas9 tehnologije za istraživačke svrhe nemjerljiva i već sada neupitna, koliki će biti utjecaj na ljudsku svakodnevnicu, hoće li zaživjeti u kliničkoj primjeni i hoće otvoriti vrata prepravljanju ljudskog genoma i u konačnici ljudske vrste, tek će se pokazati. Osim tehnološkog razvoja i usavršavanja, nesumnjivo nas čekaju žestoke rasprave na polju etike, sociologije, ekonomije i zakonske regulative.
Korisne poveznice:
https://youtu.be/jAhjPd4uNFY – popularnoznanstveni pregled razvoja i primjene sustava CRISPR-Cas9
https://youtu.be/TdBAHexVYzc – o sustavu CRISPR-Cas9 iz ustiju jedne od otkrivačica, Jennifer Doudna
http://www.nature.com/news/crispr-the-disruptor-1.17673 – pregled izazova koje pred znanstvenu zajednicu i širu javnost stavlja sustav CRISPR-Cas9
http://www.sciencemag.org/news/2017/08/first-us-based-group-edit-human-embryos-brings-practice-closer-clinic – detalji o prepravljanju genoma ljudskih embrija (kolovoz 2017)