MOLEKULARNA BIOLOGIJA
Univerzalna antitumorska cjepiva. Neočekivana korist razvoja mRNA tehnologije
 Tamara Čačev / 16. veljače 2026. / Perspektive / čita se 10 minuta
Tamara Čačev / 16. veljače 2026. / Perspektive / čita se 10 minuta
 Tamara Čačev / 16. veljače 2026. / Perspektive / čita se 10 minuta
Tamara Čačev / 16. veljače 2026. / Perspektive / čita se 10 minuta

Kontrolirano poticanje urođene i stečene imunosti čini mRNA cjepiva posebno zanimljivima u onkologiji, piše Tamara Čačev. Do danas je pokrenuto više od 120 kliničkih ispitivanja ciljanih mRNA cjepiva za tumorske bolesti u rasponu od melanoma, raka pluća i dojke do izazovnih tumora poput gušterače i tumora mozga, uz stalni rast broja kombiniranih pristupa.
Nakon što se pokazalo netočnim „predviđanje“ teoretičara zavjera da će cijepljeni protiv SARS-CoV-2 većinom pomrijeti do 2026., ili koji god rok da je bio, nedavno je objavljeno istraživanje koje tvrdi upravo suprotno. Naime, u retrospektivnoj studiji provedenoj u MD Anderson Cancer Center u Houstonu, objavljenoj krajem prošle godine, pokazalo se da je ukupno preživljenje 180 oboljelih od raka bilo gotovo udvostručeno među onima koji su primili cjepivo protiv COVID-19 temeljeno na mRNA tehnologiji unutar 100 dana od početka njihove antitumorske imunoterapije. Ovo je otkriće značajno jer pokazuje kako mRNA cjepiva potencijalno imaju kolateralni učinak suzbijanja tumorske bolesti iako nisu skrojena tako da ciljaju neki tumorski antigen (1).
Tehnologija cjepiva temeljenih na mRNA (o kojima sam već pisala za Ideje) je u pandemiji pokazala da se može brzo dizajnirati te snažno potaknuti imunosni sustav na učinkovitiji rad. Upravo taj drugi aspekt – kontrolirano poticanje urođene i stečene imunosti – čini mRNA cjepiva posebno zanimljivima u onkologiji. Do danas je pokrenuto više od 120 kliničkih ispitivanja ciljanih mRNA cjepiva za tumorske bolesti u rasponu od melanoma, raka pluća i dojke do izazovnih tumora poput gušterače i tumora mozga, uz stalni rast broja kombiniranih pristupa.
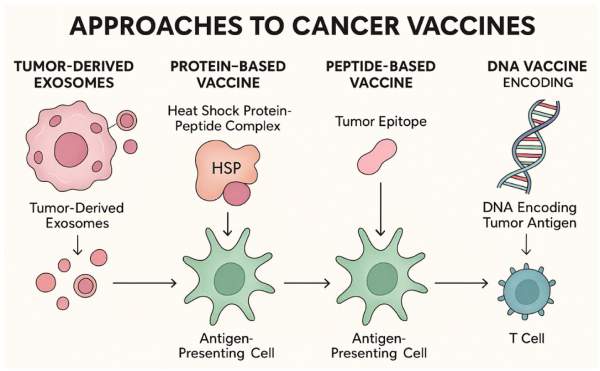
Dvije su glavne strategije razvoja ovih terapija. Personalizirana neoantigenska mRNA cjepiva razvijaju se na temelju informacija sekvenciranja tumora određenog oboljelog te se zatim odabiru neoantigeni s najvećom vjerojatnošću prezentacije (HLA) i imunogenosti. U mRNA se potom ugrade određene sekvence koje najbolje odgovaraju terapiji tumora tog oboljelog. Drugi pristup uključuje fiksni panel zajedničkih antigena ili virusnih onkoproteina koji se najčešće pojavljuju u nekom tipu tumora, gdje se ne cilja individualni set mutacija nekog oboljelog, nego “targeti” koje dijeli veći broj bolesnika (npr. HPV16 E6/E7 u HPV-povezanim karcinomima). Prednost ovakvog pristupa je skalabilnost i brža dostupnost, ali mana je što je terapija manje prilagođena konkretnom oboljelom.
Ovakva mRNA cjepiva mogla bi biti korisna i u sinergiji s nekim od novijih tipova antitumorske terapije, inhibitorima kontrolnih točka, poznatijih pod svojim engleskim nazivom immune checkpoint inhibitors (ICI), koji su posljednjih godina promijenili liječenje niza zloćudnih bolesti. Princip prema kojem djeluju jest da kod dijela bolesnika mogu “osloboditi kočnice” imunološkog sustava i omogućiti T-limfocitima da učinkovitije napadnu tumor. Problem je što velik broj tumora u startu nije dovoljno „vidljiv“ našem imunološkom sustavu. U takvim imunološki „hladnim“ tumorima nema snažne početne upale ni prethodno pripremljenih antitumorskih T-stanica pa ICI često nemaju na što djelovati. U tom kontekstu posebno je zanimljiva ideja stvaranja okruženja u kojem će imunološki sustav dobiti poticaj da prepozna tumorske antigene i pokrene napad. Personalizirana mRNA cjepiva protiv raka upravo to pokušavaju budući da ciljaju unaprijed odabrane tumorske antigene i tako namjerno usmjeravaju imunološki odgovor. No, takva cjepiva zasad imaju dosta prepreka budući da je proizvodnja složena, skupa i dugotrajna, jer se sve mora prilagoditi pojedinom bolesniku.
Stoga istraživanje s početka ovog teksta pokazuje da mRNA cjepiva koja uopće nisu “dizajnirana” za neki tumorski antigen već za SARS-CoV-2 svejedno mogu učiniti tumore osjetljivijima na ICI terapiju. Drugim riječima, cjepivo protiv virusnog antigena može djelovati kao snažan imunološki modulator koji u tijelu pokreće kaskadu događaja korisnu i za antitumorski imunitet. Mehanizam koji se ističe u pretkliničkim modelima uključuje porast interferona tipa I, ključnog signalnog sustava urođene imunosti. Interferon tipa I djeluje poput alarma koji aktivira urođene imunološke stanice (npr. dendritičke stanice i druge mijeloidne populacije) koje zatim učinkovitije prezentiraju antigene našem imunološkom sustavu i pripremaju CD8+ citotoksične T-limfocite.
Važno je da ti CD8+ T-limfociti ne moraju ciljati virus već se u ovom slučaju oni mogu usmjeriti na tumorske antigene koji su već prisutni u organizmu, ali prije nisu bili dovoljno imunološki vidljivi. Ovakvo povećanje vidljivosti tumora našem imunološkom sustavu može potaknuti i obrambenu reakciju tumora – povećanje ekspresije PD-L1, molekule koja tumor koristi kao štit protiv T-stanica. Naime, radi se o svojevrsnom paradoksu u kojem što imunološki sustav postaje aktivniji, tumor aktivira mehanizme izbjegavanja. Upravo tu ICI terapija (blokada PD-1/PD-L1 osi i srodnih kontrolnih točaka) sprječava tumor da ponovno pritisne kočnicu.
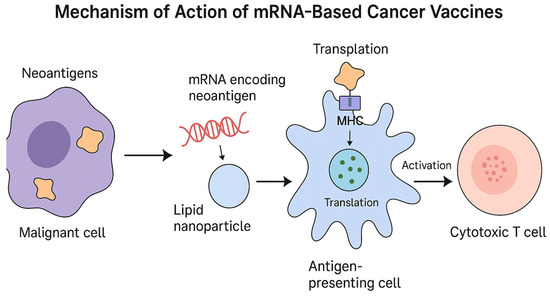
Ovakvi nalazi naravno moraju biti dodatno potvrđeni u prospektivnim studijama, no svakako zvuče obećavajuće. Otežavajuća okolnost bit će smanjeno financiranje ovakvih istraživanja od strane vlade SAD-a koja je srezala sredstva za istraživanja u ovom području za gotovo 500 milijuna dolara prošle godine uz obrazloženje da je tehnologija mRNA nesigurna. Ipak, ukoliko se ovi rezultati potvrde u prospektivnim studijama, to bi značilo da već dostupna, standardizirana mRNA cjepiva mogu imati ulogu “općeg” imunološkog pojačivača u kombinaciji s ICI terapijom, bez potrebe za individualiziranom proizvodnjom cjepiva, što bi u najboljem scenariju vodilo do univerzalnog antitumorskog cjepiva. Dodatno, moguće je da i druga mRNA cjepiva usmjerena na antigene nepovezane s tumorom mogu služiti kao kontrolirani način aktivacije urođene i posljedično stečene imunosti, čime se povećava vjerojatnost odgovora na imunoterapiju.
Pri tome valja uočiti bitnu funkcionalnu razliku između mRNA cjepiva kao antitumorske terapije i klasične funkcije cjepiva. Za razliku od profilaktičkih cjepiva protiv infekcija, terapijska cjepiva ne sprječavaju nastanak tumora, nego pokušavaju usmjeriti i pojačati antitumorski T-stanični odgovor.
Pri tome mRNA služi kao uputa stanici da proizvede ciljane antigene (npr. neoantigene nastale mutacijama tumora), koje zatim antigen-prezentirajuće stanice (APC) procesiraju i prikazuju našim T-stanicama. To je bitno jer tumori često stvaraju mikrookoliš koji je namjerno što manje vidljiv našem imunološkom sustavu. Malo efektorskih T stanica ulazi u tumor, a one koje uđu brzo postaju iscrpljene. Ovakva terapija prvenstveno je zamišljena kao dodatni podstrek terapijama koje uklanjaju imunološke kočnice (inhibitori kontrolnih točaka poput anti-PD-1/PD-L1), mijenjaju mikrookoliš tumora (npr. određeni kemoterapijski režimi, zračenje) ili ciljaju dodatne imunološke osi.
Osim ovako nespecifičnog i potencijalno pantumorskog djelovanja mRNA cjepiva, i dalje se radi na mRNA cjepivima koja gađaju specifične mete u tumoru konkretnog pacijenta. U proljeće prošle godine objavljena je studija koja dodatno potvrđuje korist mRNA cjepiva ciljanih na specifične tumorske markere. U studiji provedenoj na oboljelima od tumora gušterače koji je izrazito problematičan, kako s aspekta dijagnostike tako i s aspekta terapije, cjepiva temeljena na ovoj tehnologiji, a koja ciljaju točno određene biljege tumora, uspjela su produljiti preživljenje bez ponovne pojave bolesti za godinu i više, što je naravno veliki uspjeh (2). Ovaj rad objavljen u časopisu Nature bavi se temeljnim izazovom svih tumorskih cjepiva, a to je kako proizvesti dugotrajne, funkcionalne T-stanice specifične za tumor, i to za duktalni adenokarcinom gušterače, tumor u kojem je prisutno relativno malo mutacija pa time i manje neoantigena na koje bi mogli ciljati nekom terapijom.
U ovoj su studiji za svakog oboljelog napravili mRNA cjepivo iskrojeno prema specifičnostima njegovog tumora. To znači da je sekvencirana DNA tumorskih stanica, zatim su identificirane specifične mutacije te su na temelju njih računalno predviđani neoantigeni. Na temelju tako dobivenih informacija dizajnirana je mRNA koja je kodirala specifični skup neoepitopa (ciljeva na koje će djelovati imunološki sustav). U produljenom praćenju (medijan 3,2 godine), bolesnici su podijeljeni prema tome jesu li nakon cjepiva razvili mjerljiv T-stanični odgovor na neoantigene. Također je istraživano jesu li tako dobivene T-stanice prolazni val ili dugotrajna memorija te je prosječno procijenjen životni vijek klonova bio približno 7,7 godina s time da je oko 20% klonova imalo procijenjen višedesetljetni “latentni” životni vijek dok je 6% klonova po bolesniku ostalo prisutno i do tri godine nakon cijepljenja.
Dvoje sudionika studije koji su imali dobar odgovor na terapiju ipak je recidiviralo tijekom praćenja. Autori opisuju da su oba slučaja imala slabiju kumulativnu “dozu imunosti” (kraću postojanost ili kasniji nastup klonova). U njihovim tumorima bili su također vidljivi znakovi imunoeditiranja tumorskih klonova koji nose cjepivom ciljane (imunogene) neoantigene. Drugim riječima, tumor kao da se selekcijski “pomaknuo” pod pritiskom induciranih T-stanica. S jedne strane to ukazuje na stvarni biološki učinak imunosti, a s druge podsjeća da klonalni bijeg može biti mehanizam rezistencije na terapiju. Značaj ove studije leži u tome što ona pokazuje kako personalizirano mRNA neoantigensko cjepivo može inducirati dugotrajnu CD8+ memoriju u solidnom tumoru koji je klasično imunološki “hladan”, no ipak treba naglasiti i činjenicu da je u studiju bio uključen mali broj oboljelih. Ovaj pristup je zanimljiv jer preskače dio problema odabira mete, ali uvodi druge izazove kao što su dostupnost lezije za injiciranje, heterogenost unutar i između metastaza te pitanje koliko lokalni signal postaje sustavan.
Treći smjer kojim bi ove terapije mogle ići jest intratumoralna mRNA kojom bi se reprogramirao mikrookoliš tumora, dakle mete ne bi bile same tumorske stanice nositelji mutacije. Ovdje bi mRNA primarno kodirale za imunostimulacijske signale (npr. IL-23, IL-36γ) koji se daju intratumoralno kako bi se mikrookoliš tumora prebacio iz “hladnog” u “vrući”.
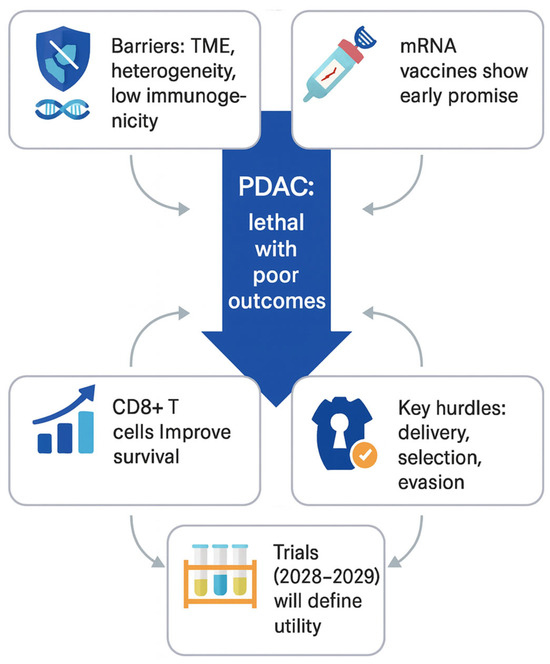
Ipak, da ne bi sve bilo idilično ni antitumorske terapije temeljene na mRNA nisu bez problema. Jedan od njih je kako mRNA dovesti do pravih stanica u pravom tkivu, zatim precizno doziranje i regulacija jačine imunološkog odgovora (da bude dovoljno snažan protiv tumora, ali bez nepotrebne toksičnosti i iscrpljivanja). Također, ni meta koju gađamo nije statična, jedna od velikih prepreka svim antitumorskim terapijama je heterogenost tumora. To znači da u svakom tumoru postoje različiti klonovi stanica s malim mutacijskim razlikama koje im u trenutku selekcijskog pritiska kakav je svakako davanje neke terapije mogu omogućiti da razviju rezistenciju i prerastu u dominantni klon, na sličan način kako bakterije razvijaju rezistenciju na antibiotike. Zatim, i sam mikrookoliš tumora može djelovati imunosupresivno, a bitno je i odabrati pravu metu – neoantigen tumora koji će biti u stanju dovoljno aktivirati obrambene mehanizme imunološkog sustava. Sam proces proizvodnje takvih mRNA cjepiva je također vrlo personaliziran, tj. prilagođeno se rade za određenog pacijenta nakon što se sekvencira genom njegovog tumora. Taj proces, osim što je tehnološki sofisticiran i traži specifične uvjete rada i ekspertizu, također zahtijeva i neko vrijeme. Ipak, napredak je vidljiv te mRNA cjepiva više nisu samo u sferi ideje već su došla do kliničke razine i prvi rezultati su ohrabrujući.
Tumorske bolesti su jedan od najvećih svjetskih zdravstvenih izazova te drugi po redu uzrok smrti u svijetu. Smatra se da će do 2050. biti i do 35 milijuna oboljelih. Istovremeno, iako je ohrabrujuće da su istraživanja u području njihove terapije sve plodonosnija, takve terapije su izrazito skupe i svakako opterećuju zdravstvena osiguranja. Predviđa se da će liječenje oboljelih u SAD-u idućih 30 godina koštati više od teško zamislivih 25 trilijuna dolara. Stoga ideju o proizvodnji relativno jeftinih mRNA terapija, jednoga dana kad se cijeli sustav uspostavi i dođe do masovne proizvodnje (pri čemu je istraživanje i dalje izrazito skupo), nije tako lako odbaciti.
1) Grippin AJ, Marconi C, Copling S, Li N, Braun C, i sur. SARS-CoV-2 mRNA vaccines sensitize tumours to immune checkpoint blockade. Nature. 2025 Nov;647(8089):488-497. doi: 10.1038/s41586-025-09655-y.
2) Sethna Z, Guasp P, Reiche C, Milighetti M, Ceglia N, Patterson E, i sur. RNA neoantigen vaccines prime long-lived CD8+ T cells in pancreatic cancer. Nature. 2025 Mar;639(8056):1042-1051. doi: 10.1038/s41586-024-08508-4.