Medicina/biologija
Nagrade koje konkuriraju Nobelu opravdano dodijeljene za razvoj tehnologije suvremenih cjepiva. Desetljeća napora
 Tamara Čačev / 27. listopada 2021. / Članci / čita se 14 minuta
Tamara Čačev / 27. listopada 2021. / Članci / čita se 14 minuta
 Tamara Čačev / 27. listopada 2021. / Članci / čita se 14 minuta
Tamara Čačev / 27. listopada 2021. / Članci / čita se 14 minuta

Svakome iz struke smiješno je čuti kako ne znamo od čega se sastoje ova nova cjepiva, piše Tamara Čačev, u članku u kojem opisuje desetljeća istraživanja 'stotina znanstvenika sa mnogo slijepih ulica za koja je trebalo osigurati sredstva, iako neposredna primjena i profit nisu bili na vidiku', a koja su na kraju rezultirala nagradama znanstvenicima u području mRNA tehnologije. Privatne kompanije imale su bolji njuh od onih koji upravljaju javnim istraživačkim fondovima
Ovih dana pandemija COVID-19 je u punom jeku i vjerojatno je već svima jasno kako iz ovog limba možemo izaći na dva realna načina (ako izuzmemo doomsday prepper pristup potpune izolacije) a to je da mi upravljamo svojim zdravljem ili da ono upravlja nama. Kontrolirani pristup, koji nam je omogućio uspon znanosti, bio bi cijepljenje a nekontrolirani stihijski, možemo reći ‘prirodni/organic’ a u realitetu predmoderno-pećinski bio bi preboljevanje. Također je vjerujem svima jasno da ova bolest može imati fatalne posljedice za koje većina mlađih vjeruje kako se događaju nekome drugome, a o dugoročnim posljedicama možemo tek nagađati. Problem u ovakvom pristupu jest da – iako se možemo pouzdati u statistiku kako mlađi ne završavaju kobno – još postoji određeni broj njih koji će izvući taj neželjeni jack-pot. Jasno je i da između smrti i oporavka nakon hospitalizacije stoji još čitav spektar stanja u kojima se ljudi nikad ili jako dugo vremena neće vratiti u svoju prijašnju snagu.
Pa ipak, danas, nepune dvije godine od početka pandemije, imamo u potpunosti odobreno cjepivo protiv SARS-Cov-2 virusa, i dalje se u javnosti šire teze kako se radi o nedovoljno provjerenom, eksperimentalnom poluproizvodu kojeg je cilj samo prodati i dobro naplatiti. Ljude zbunjuje kako je moguće da se u tako kratkom vremenu dođe do cjepiva kada je u prijašnjim pandemijama takav proces trajao desetljećima, ako izuzmemo svo ono vrijeme prije moderne medicine kada nisu postojali niti znanstveni preduvjeti da se cjepiva uopće zamisle kao imaginarni koncept. No, to što smo gotovo cijelo stoljeće imali sreću da nas nije zadesila neka strašnija pandemija te smo uživali u blagodatima antibiotika i cjepiva ne razmišljajući o znanosti koja stoji iza toga, ne znači da se ona nije “dogodila”. Iako u našem antropocentričnom svijetu sve mjerimo prema tome koliko nešto predstavlja veliku ugrozu za naše zdravlje, u nama paralelnom svijetu veterinarske medicine borba s epidemijama i pandemijama nikada nije prestala. Stoga veliki dio spoznaja o zaraznim bolestima kao i razvoj novih tehnologija u području cjepiva možemo zahvaliti razvoju ovog segmenta znanosti.
Za razliku od ovogodišnje Nobelove nagrade, Breakthrough Prize 2022, nagrada s najvećom materijalnom težinom (3 milijuna dolara) koju su osnovali IT magnati na čelu Facebooka i Googlea i po nekima predstavlja Nobelovu nagradu novog doba jer puno bolje prepoznaje otkrića od ogromnog doprinosa za čovječanstvo, te ‘američki Nobel’” za područje medicine, nagrada Lasker za klinička medicinska istraživanja dodijeljeni su dr. Drewu Weissmanu i dr. Katalin Karikó sa Sveučilišta u Pennsylvaniji za njihov doprinos u području razvoja mRNA tehnologije.1 Treba dodati kako je Breakthrough Prize 2022 uključila u dobitnike i Shankara Balasubramaniana, Davida Klenermana, te Pascala Mayera za razvoj nove generacije sekvenciranja (engl. “next generation sequencing”) koja je omogućila da se ubrza sekvenciranje genoma kako čovjeka tako i drugih organizama te danas poduhvat sekvenciranja genoma čovjeka koji je trajao desetljeće možemo napraviti za svega nekoliko dana.


Kako to obično biva, niti istraživanja ovog dvojca nisu se dogodila preko noći. Naime, već je dekadama prije postojala ideja kako bi bilo korisno u naš organizam ubaciti molekule mRNA kao kratkotrajne vektore koji bi obavili svoju ulogu time da potaknu stanice na proizvodnju nekog ciljanog proteina a zatim bi se ta mRNA uklonila prirodnim tijekom raspada. Ovakve promjene bile bi tranzitorne, za razliku od primjerice trajnih izmjena genoma na razini DNA što je uz to što je etički kontroverzno također i (zasad) teže provedivo. Takve ciljane intervencije pogodne su, kako se upravo potvrđuje u praksi, za kontrolirano uvođenje nekog proteina patogena kao što je to protein Spike virusa SARS-CoV-2 na koji onda naš imunosni sustav razvija adekvatnu preventivnu zaštitu a bez opasnosti od razvoja kliničke slike bolesti.
No, teoretski koncept je jedno, a praktična izvedba nešto sasvim drugo. Pokazalo se da je uvođenje strane mRNA u naš organizam skopčano s nizom mehanizama kojima se on brani od svega što ne prepoznaje kao svoje. To je način kako se zapravo štitimo od virusa koji u osnovi rade istu stvar – unose stranu RNA ili DNA i koriste mehanizme umnažanja stanice za svoje potrebe. Stoga je prepoznavanje ‘naše’ od ‘strane’ DNA ili RNA te njihova eliminacija mehanizam koji je prisutan u gotovo svim živim bićima i njega je trebalo zaobići ako želimo korisititi ove molekule kao vektore za unos ciljanih kodirajućih sekvenci u organizam. U radu koji je dvojac Weissman i Karikó objavio 2005. g opisano je kakve modifikacije moraju sadržavati molekule RNA kako bi preživjele unos u organizam a da ih naš imunosni sustav ne eliminira u startu.2 Naime, DNA i RNA drugih organizama stimuliraju imunološki sustav sisavaca putem prepoznavanja pomoću tzv. Toll like receptora (TLR). Međutim, molekule DNA koje su metilirane na specifičnim mjestima, tzv CpG otocima, kako je to slučaj i s našom DNA, bivaju tolerirane. Stoga su Weissman i Karikó vodeći se sličnom logikom i u molekulama RNA sisavaca također pronašli ‘signale za toleranciju’. Radilo se o metilaciji nukleotidnih baza na specifičnim mjestima (m5C, m6A, m5U, s2U) te uvođenju baze pseudouridina. Tako modificirane molekule RNA u puno manjoj mjeri su aktivirale dendritičke stanice imunološkog sustava koje su proizvodile znatno manje citokina i drugih aktivacijskih biljega u odnosu na stimulaciju nemodificiranom RNA. Dakle, pokazali su kako ‘naša’, RNA za razliku od one bakterija i virusa, ima niz modifikacija koje služe kao oznake za toleranciju od našeg imunološkog sustava. Upravo je uvođenje ovih modifikacija u de novo sintetiziranu mRNA, kako bi mogla neometano ući u stanicu a da je naš imunološki sustav prethodno ne eliminira, bilo ključno za razvoj efikasnih cjepiva temeljenih na RNA tehnologiji (Slika 1).
Otkriće modifikacija u molekuli RNA koje ju čine manje imunogenom označilo je prekretnicu u razvoju cjepiva temeljenih na ovom konceptu. No, kako je prethodno spomenuto, ideja je već bila prisutna nekoliko dekada prije.
Pionir u ovom području, a tada još student, Robert Malone je 1987.g. napravio eksperiment u kojem je pomiješao mRNA s kapljicama masti te ovom smjesom tretirao humane stanice u kulturi in vitro. U takvim uvjetima u odsutnosti imunološkog odgovora, stanice su preuzele mRNA u svoju unutrašnjost te počele proizvoditi protein koji je ta mRNA kodirala. Na taj način rođena je ideja molekule RNA kao potencijalnog lijeka koji bi se mogao ciljano administrirati na način da ih se zapakira u čestice masti. Masna ovojnica služi kako bi zaštitila RNA i kako bi se spajanjem s membranom naših stanica omogućio unos sadržaja čestice u stanicu. I upravo je to ono što mi koristimo danas u mRNA cjepivima. Stoga su svakome iz struke smiješne izjave o tome kako ne znamo od čega se sastoje ova nova cjepiva. Sastoje se od nikad manje sastojaka – modificirne RNA i masnih čestica tipa liposoma koje koristimo odavno u kozmetičkoj industriji. No, da ne bi bilo zabune, prvotni ekperimenti s modificiranim nukleinskim kiselinama i pakiranjem u čestice masti nisu bili tako uspješni kao današnje cjepivo (slika 2). Između ovoga što imamo danas i prije spomenutih istraživanja još su mnogi znanstvenici kroz godine dali svoj doprinos, iako se Malone prilično neskromno samoproglasio izumiteljem mRNA cjepiva. Jasno je da ni njegova originalna verzija čestica nije ona koja se danas koristi jer je trebalo još dosta dorađivanja, a bez eksperimentalnog rada Weissmana i Karikó ne bi imala nikakvu praktičnu primjenu jer je nemodificirana mRNA neupotrebljiva u ove svrhe. Ovo je zapravo tek jedna tipična priča o godinama istraživanja stotina znanstvenika sa mnogo slijepih ulica za koja je između ostalog trebalo osigurati sredstva, iako neposredna primjena i profit nisu bili na vidiku.
Više je grupa radilo na tehnologiji RNA cjepiva i bile su jako blizu uporabljivih proizvoda, no nedostajalo im je sredstava da se taj proces dovede do kraja jer nije postojao interes za razvoj cjepiva u doba kada pandemije nisu bile realnost u glavama investitora
Znanstvenici su već je prije Malonea napravili neke preliminarne eksperimente unosa mRNA ekstrahirane iz nekih bioloških izvora u stanice, no on je to prvi učinio sa sintetičkom mRNA u liposomima u stanicama čovjeka. To je bilo moguće budući da je nekoliko godina prije prvi puta u laboratoriju de novo sintetizirana biološki aktivna mRNA a za taj podvig zaslužni su Melton, Maniatis (inače poznati autor laboratorijskih protokola koji se i danas koriste) te Green sa Sveučilišta Harvard. No niti ovoj trojici ni Maloneu nije, kako i sami priznaju, bila na pameti klinička primjena nego primjena u znanstvenim istraživanjima pa je tako Harvard prepustio patent za sintezu RNA danas megaplanteranoj tvrtki za proizvodnju reagenasa za molekularnu biologiju – Promegi. Ona prethodno spomenuta Maloneova samohvala dijelom je i rezultat gorčine jer je izgubio prava na patent u dogovoru velikih šefova na Institutu Salk gdje je započeo doktorat koji nije završio i biotehnološke firme u kojoj je nastavio svoj rad na ovoj tematici. Nakon svega, razočaran završio je studij medicine i opet se vratio u istraživanja ali ovaj put u područje DNA cjepiva jer u području RNA tehnologije nije mogao dobiti sredstva za projekt. Zapravo, kada se pogleda retrogradno, više je grupa radilo na tehnologiji RNA cjepiva i bili su jako blizu uporabljivih proizvoda, no nedostajalo im je sredstava da se taj proces odigra do kraja jer nije postojao interes za razvoj cjepiva u doba kada pandemije nisu bile realnost u glavama investitora. Kao platforma, molekula DNA je bila puno stabilnija i stoga perspektivnija za razvoj novih cjepiva. I uistinu, takav pristup urodio je plodom u veterinarskoj medicini gdje je nekoliko prvih cjepiva odobreno za upotrebu na životinjama a temeljeno na DNA kao vektoru. Nije to skroz neopravdan odabir jer, kao što vidimo i danas, nije riješeno pitanje stabilnosti RNA cjepiva koja se stoga moraju čuvati na izrazito niskim temperaturama što stvara prilične logističke probleme u distribuciji i skladištenju što je u normalnim okolnostima u kojima je bila razmatrana njihova proizvodnja predstavljalo veliki nedostatak u odnostu na “tradicionalna” cjepiva.
Kasnije, tijekom devedesetih napravljeni su prvi eksperimenti s mRNA cjepivom za gripu i za neke ciljne proteine tumora na miševima no bez nekog posebno značajnog uspjeha upravo zbog problema korištenja nemodificirane mRNA. U prvoj dekadi ovog stoljeća su osnovane kompanije BioNTech, CureVac i Moderna čije ime je danas poznato mnogima, a neki su na njihovim dionicama i podosta zaradili. Interesantno je da su supružnici Şahin i Türeci iz BioNTecha još 2007.g. od investitora dobili 150 milijuna eura za svoj start-up kao vrlo rizično istraživanje, dok su ovogodišnji laureati nagrade Lasker te iste godine dobili tek nešto manje od 100 tisuća dolara iz američkog proračuna za svoja istraživanja modifikacije sintetičke mRNA kako bi prošla mimo kontrole imunološkog sustava a bez kojih nitko od prije spomenutih ne bi mogao napraviti konačni iskorak. No, i u ovoj priči nije bilo previše sreće za znanstvenike u patentiranju svojeg istraživanja. Kako je kompanija koju su osnovali bila izdanak Sveučilišta u Pennsylvaniji, njihov ured za tehnologiju prodao je patentna prava za 300 tisuća dolara maloj tvrtki za proizvodnju reagenasa za molekularnu biologiju iako je u igri za ta prava već tada bila i novoosnovana mala i nepoznata tvrtka Moderna. Ne treba ni govoriti kako u ovome trenutku ta mala tvrtka zarađuje stotine milijuna dolara od prepuštanja patenta Moderni i BioNTechu.
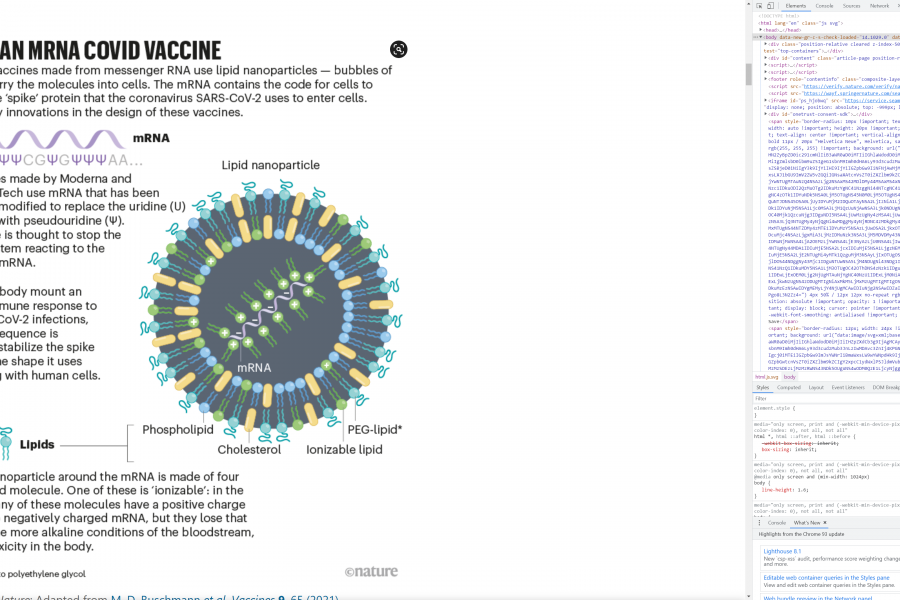
Što se tiče lipidnog omotača za mRNA već je devedesetih pod vodstvom Pietera Cullisa sa Sveučilišta British Columbia u Vancouveru napravljena lipidna nanočestica kakve poznajemo danas i kakva se koristi i u ovim cjepivima. Nanočestice se sastoje od četiri tipa lipidnih molekula. Tri imaju strukturnu funkciju i grade česticu dok je četvrta ionizirani pozitivno nabijeni lipid i ona je bila ključna za uspjeh ove čestice jer joj daje stabilnost i omogućuje dulji život u proizvodnji i distribuciji te je manje toksična u fiziološkim uvjetima u organizmu. Sredinom 2000.-tih uspostavljena je i reproducibilna i stabilna proizvodnja miješanih mRNA nanočestica te je to omogućilo njihovu masovnu produkciju. Patentna prava su i ovdje predmet spora ovaj puta između jedne Cullisove tvrtke i Moderne.
Kada je konačno riješen problem modifikacije mRNA kao i skalabilne proizvodnje lipidnih čestica po prvi puta su neka od mRNA cjepiva (bjesnoća i gripa) došla i do faze kliničkih testiranja. Osim u području cjepiva, pakiranje RNA u liposome doživljelo je prvi veliki proboj i u području lijekova pa je 2018.g na tržište došao lijek patisiran za obiteljsku amiloidozu. Riječ je o nasljednoj bolesti u kojoj dolazi do nakupljanja mutiranog proteina transtiretina u jetri te za koje je do tada bila potrebna transplantacija jetre. Radi se zapravo o jednoj vrsti genske terapije budući da se u liposomima nalazi RNA koja utišava proizvodnju mutiranog transtiretina. Nažalost, kako se radi o rijetkoj bolesti troškovi istraživanja pretočeni su u cijenu lijeka koji na godišnjoj bazi za jednog oboljelog košta oko pola milijuna dolara. Jasno je da toliko ne vrijedi malo nukelotida i masti na što se u konačnici svodi kemijski sastav ovog lijeka, no sve što je njemu prethodilo koštalo je i značajno više. Stoga se unatoč tome što se to prikazuje kao ogroman prihod farmaceutskih kompanija ova sredstva danas troše za istraživanja koja će možda (a možda i ne, što je puno češći ishod) dati neki blockbuster lijek u budućnosti. Interesantno je kako je jedini laureat Breakthrough Prize 2022 izvan kruga modificirane mRNA i next generation sequencinga J.W. Kelly nagradu dobio za svoj doprinos razotkrivanju molekularne osnove neuroloških i srčanih bolesti uzrokovanih upravo mutacijama trastiretina.
Prema nekim novim spoznajama postoji mogućnost da se i nemodificirana mRNA ipak iskoristi za efikasan proizvod ako se naprave izmjene na njenom početku te ona pročisti tehnologijama koje su danas dostupne. No ta ideja tek treba zaživjeti i biti dokazana u kliničkim istraživanjima. Da ovo nije tek puka hipoteza pokazuje i ulaganje velike farmaceutske kompanije Sanofi od nešto više od tri milijarde dolara u ljeto ove godine u ovaj pristup.
Iz svega navedenog jasno je kako se tehnologija mRNA umotane u lipidnu nanočesticu nije tek tako dogodila od danas do sutra te se ne radi o nečem eksperimentalnom i prigodno sklepanom da se zaradi na ‘malom čovijeku’. U tvrtku Moderna još je 2015. g uložena milijarda dolara za istraživanje mRNA cjepiva te su u trenutku pred epidemiju u razvoju imali skoro 10 novih cjepiva baziranih na ovoj tehnologiji. RNA tehnologija je već neko vrijeme s nama i stoga nije bilo iznenađenje kada se u svega nekoliko dana od javne objave sekvence virusa bioinformatičkim metodama pronašla najpogodnija meta iz genoma virusa-protein Spike. Ubrzo je sintetizirana modificirna mRNA koja je kodirala za ovaj protein i nanočestica te su započela prva predklinička i klinička istraživanja.
Interesantno je da je tehnologija lipidnih nanočestica dobila odobrenje za primjenu u klinici prije tehnologije modifikacije mRNA kada je 2018.g. odobren lijek patisiran dok je odobrenje za kliničku primjenu tehnologije modifikacije mRNA doživjela tek u cjepivu protiv SARS-CoV-2.
Ipak, modifikacija i ugradnja pseudouridina u mRNA smatra ključnim probojem koji je omogućio današnja mRNA cjepiva što je doprinos koji je osjetilo cijelo čovječanstvo naspram blagodati prije spomenutog “orphan” lijeka za mali broj oboljelih. Stoga se smatra kako je otkriće Weissmana i Karikó upravo ono koje je vrijedno nagraditi danas Breakthrough Prizeom i američkim Nobelom a za koju godinu možda onim pravim.