Nobelova nagrada za kemiju 2017
Renesansa elektronske mikroskopije, ili kako starog psa naučiti nove trikove
 Marko Močibob / 6. listopada 2017. / Članci / čita se 6 minuta
Marko Močibob / 6. listopada 2017. / Članci / čita se 6 minuta

 Marko Močibob / 6. listopada 2017. / Članci / čita se 6 minuta
Marko Močibob / 6. listopada 2017. / Članci / čita se 6 minuta

Nobelovu nagradu iz kemije za 2017. godinu dobili su Jacques Dubochet, Joachim Frank i Richard Henderson za razvoj krioelektronske mikroskopije visoke rezolucije, čime je otvorena mogućnost uvidu u strukture bioloških makromolekula ili čestica čija struktura do sada nije bila dostupna modernoj znanosti
Elektronski mikroskopi temelje se na neobičnom svojstvu elektrona (i ostalih čestica) da dok se kreću imaju valna svojstva, tj. da se ponašaju poput valova ili svjetlosti. Hipotezu je postavio Luis de Broglie 1924. godine, a ubrzo je i eksperimentalno potvrđena. Prvi elektronski mikroskop sagrađen je već 1931. godine, dakle prije 86 godina. Doista, radi se o prilično staroj tehnologiji. Zašto su nam uopće potrebni elektronski mikroskopi, i zašto njihova rezolucija (povećanje) uvelike premašuje upotrebljivo povećanje koje daju obični, optički mikroskopi? Razlog je u valnoj duljini svjetlosti: rezolucija mikroskopa ograničena je valnom duljinom svjetlosti. Ako želimo ići na povećanja koja su veća od 2000x, koliko je upotrebljivo povećanje optičkih mikroskopa, moramo upotrijebiti svjetlost kraće valne duljine. Da bi se “spustili” do molekula i molekulskih struktura, bio bi nam potreban mikroskop koji koristi rendgenske zrake umjesto obične svjetlosti. Ali tu imamo dva problema: rendgenske zrake su toliko velike energije da slabo reagiraju sa materijom – dobar dio materijala je za njih “proziran”, i još važnije: ne postoje leće za rendgenske zrake. Tu na scenu stupaju elektronski mikroskopi, koji pomoću snopova elektrona i magnetskih polja kao leća oslikavaju uzorak praktički do razine atoma. Suvremeni elektronski mikroskopi imaju toliku moć povećanja da praktički možemo vidjeti pojedinačne molekule i atome, a još su davne 1933. godine – samo 2 godine od prvog prototipa nadišli rezoluciju optičkog mikroskopa.
O općenitoj važnosti elektronske mikroskopije i njenoj važnosti za suvremenu znanost ne treba puno trošiti riječi: od otprilike sredine 20. stoljeća, elektronski mikroskopi se koriste praktički u svim granama prirodnih i tehničkih znanosti, a posebice u biologiji, fizici, geologiji, znanostima o materijalima poput metalurgije, primijenjene kemije, itd. Elektronske mikrofotografije virusa, dijelova stanice, peludnih zrnaca, ljuštura algi kremenjašica i sl. nalaze se u svakom udžbeniku biologije i elektronske mikrofotografije dio su kolektivne memorije 20. stoljeća.
Ipak, biološke molekule poput ribosoma i ostalih dijelova stanične mašinerije, dugo su izmicale prodornom pogledu elektronskog mikroskopa. Naime, biološki materijali i biološke molekule vrlo su osjetljive i ne mogu preživjeti uvjete pri kojima radi elektronski mikroskop: ultravisoki vakuum i bombardiranje snopom elektrona. Stoga se biološki uzorci kod “klasične” elektronske mikroskopije moraju prethodno temeljito obraditi: fiksirati prije nego se iz njih ukloni voda, a biološke strukture napraviti vidljivima naparavanjem metala poput zlata ili platine, ili natapanjem u otopinama spojeva teških metala poput osmija ili uranija.
Nezgodno je što pri tome biološke strukture zapravo stradavaju, i ne možemo vidjeti njihovu pravu molekulsku strukturu koja je tim postupcima nepovratno narušena i izgubljena. No, zadnjih godina svjedoci smo potpunog zaokreta na području elektronske mikroskopije i prave revolucije u području strukturne biologije i biokemije, jer je premošteno nekoliko važnih prepreka iza kojih su nam se skrivale biološke molekule i njihova atomska struktura. Te prepreke su uklonjene zahvaljujući radu trojice znanstvenika i njihovih timova koji su dobili Nobelovu nagradu za kemiju 2017. godine: Jacques Dubochet, Joachim Frank i Richard Henderson.
Prva prepreka je kako učiniti biološke molekule sretnima u uvjetima u kojima elektronski mikroskop radi: visoki vakuum i jak snop elektrona. Tu je značajan doprinos dao Jacques Dubochet koji je razvio metode ultrabrzog smrzavanja uzoraka u tekućem etanu i tekućem dušiku, pri čemu dolazi do tzv. vitrifikacije: tim postupkom smrznuta otopina ima neuređenu (amorfnu) strukturu, vrlo sličnu tekućoj vodi, a biološke molekule ostaju doslovno smrznute u svojoj prirodnoj konformaciji (strukturi).
Otuda naziv krioelektronska mikroskopija, jer se sve dešava pri vrlo niskim temperaturama, da bi molekule ostale zamrznute u svom prirodnom obliku (konformaciji). Vitrifikacija riješava velikim dijelom i drugi problem bioloških molekula: oštećenje elektronskim snopom. Dokle god atomi i dijelovi molekule ostaju smrznuti na svom mjestu usred udara elektrona, to neće bitno poremetiti konačnu sliku. Sljedeći problem je što biološke molekule građene mahom od lakih atoma (ugljika, dušika, kisika i vodika) daju slab kontrast u pod elektronskim mikroskopom, uklopljene u vitrificirano otapalo (slika 1).
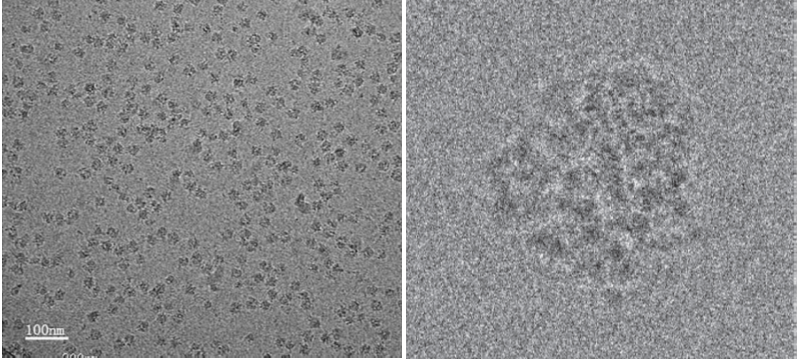
Ono što mikroskop vidi je mutna slika molekule, slabog kontrasta i puna šuma, koja se jedva nazire prema pozadini. Taj problem se riješava tako da uslikamo jako velik broj molekula ili čestica od interesa, mjereno u desecima tisuća, a onda se te slabe slike grupiraju, uprosječuju, izoštruju, ali u konačnici i mapiraju u prostoru, pa kao rezultat ne dobijemo samo statičnu sliku ili portret molekule, već trodimenzionalni model čestice ili molekule u prostoru (slika 2).
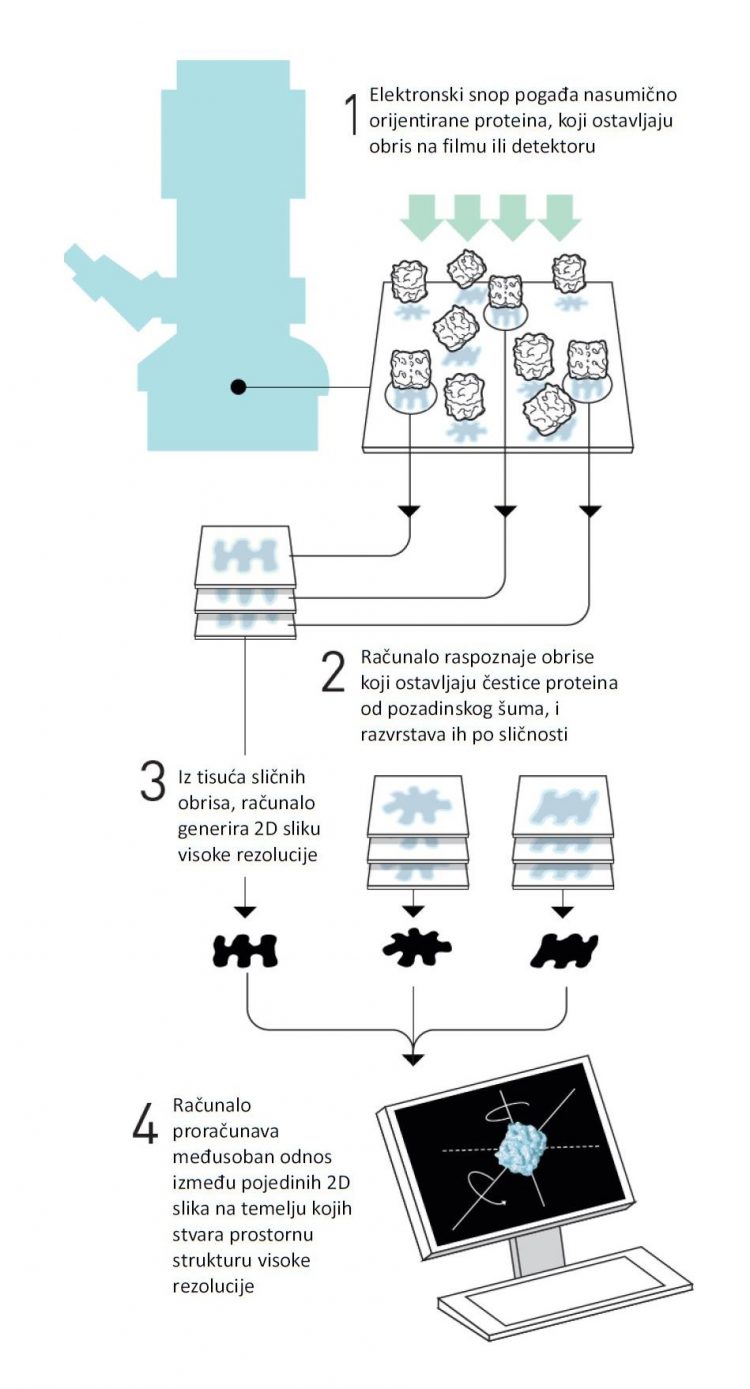
Radi se o računalno vrlo zahtjevnim i složenim algoritmima, a taj postupak i algoritme među prvima je razvio Joachim Frank, drugi od tri dobitnika ovogodišnje Nobelove nagrade. Treći laureat, Richard Henderson, zaslužan je za jednu od prvih struktura proteinske makromolekule – bakteriorodopsina koja je riješena do rezolucije bliske atomskoj rezoluciji upotrebom elektronskog mikroskopa. Njegov rad je zapravo prethodio dostignućima Joachima Francka i Jacquesa Dubocheta i stoga se koristio nešto drugačijim metodama i postupcima prilikom riješavanja strukture bakteriorodopsina, ali njegova glavna zasluga je što je pokazao da je moguće dobiti strukture bioloških molekula visoke rezolucije elektronskom mikroskopijom.
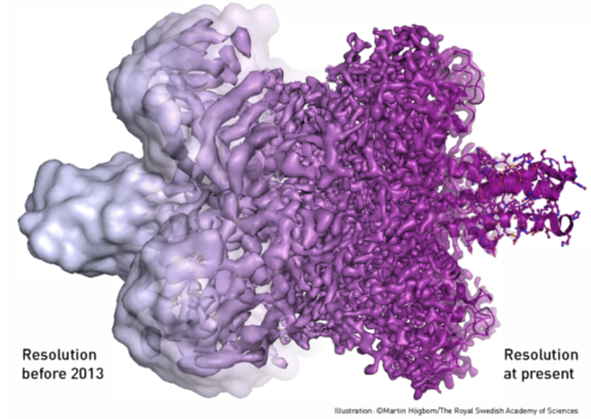
Danas je krioelektronska mikroskopija do temelja prodrmala područje strukturne biologije i biokemije, jer je pokazala da se mogu dobiti molekulske strukture bliske atomskoj rezoluciji kvalitetom usporedive s rengenskom kristalografijom. Naime, dugo vremena su se strukture kompleksnih bioloških molekula i čestica poput ribosoma (stanična tvornica proteina) riješavale metodama rengenske kristalografije. Preduvjet tome je natjerati takve kompleksne čestice da kristaliziraju, tj. stvore pravilan kristal.
To je vrlo zahtjevno, i kruna takvih napora bile su strukture ribosoma objavljene pred desetak godina, za što je dodijeljena Nobelova nagrada relativno nedavno, 2009. godine. Igrom sudbine, danas je method-of-choice za takav tip posla krioelektronska mikroskopija jer ne zahtijeva prethodnu kristalizaciju uzorka, te ju koriste i veterani rengenske kristalografije poput nobelovca iz 2009. godine Venki Ramakrishnana, ili našeg istaknutog znanstvenika iz tog područja Nenada Bana (ETH, Zürich), koji je bio suradnik nobelovca Thomasa A. Steitza i kao njegov suradnik izravno doprinio Nobelovoj nagradi iz 2009. godine.
Razvoj krioelektronske mikroskopije otvorio je mogućnost uvidu u strukture bioloških makromolekula ili čestica čija struktura do sada nije bila dostupna modernoj znanosti, čije će nam poznavanje bitno unaprijediti poznavanje života stanice, a time omogućiti napredak na svim područjima koja su s time povezana, poput medicine i farmakologije.

Korisni linkovi:
Službena objava o Nobelovoj nagradi i prateći materijali: https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2017/popular-chemistryprize2017.pdf i https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2017/advanced-chemistryprize2017.pdf