MOLEKULARNA BIOLOGIJA
Kako okoliš utječe na našu DNA? Prekidači za gene i opasnost pokušaja pomlađivanja
 Tamara Čačev / 5. lipnja 2024. / Članci / čita se 12 minuta
Tamara Čačev / 5. lipnja 2024. / Članci / čita se 12 minuta

 Tamara Čačev / 5. lipnja 2024. / Članci / čita se 12 minuta
Tamara Čačev / 5. lipnja 2024. / Članci / čita se 12 minuta

Iako ekstremni utjecaji okoliša mogu izazvati oštećenja molekule DNA, njegov je utjecaj na našu biološku osnovu uglavnom mnogo suptilniji, piše Tamara Čačev. Epigenetske promjene pod utjecajem okoliša reguliraju aktivnost gena, na reverzibilne načine, tako što "gase" i "pale" dijelove njihove ekspresije. Razumijevanje ovog procesa otvara mogućnost utjecaja na ekspresiju vlastitih gena kroz ishranu i životni stil, ali i opasnosti koje bi proizišle iz pokušaja okretanja biološkog sata.
Sav život na Zemlji programiran je zapisom u molekuli DNA. Ovaj zapis je temeljni nacrt svakog organizma koji sadrži upute o samosastavljanju i temeljnom funkcioniranju stanica. Služi također i kao podloga za kompleksnija svojstva u kojima, osim same genetike, značajnu ulogu ima i naš okoliš. Dihotomija „nature vs. nurture“ sumira ideju da je svaki čovjek rezultat djelovanja njegovih gena ali i okoline u kojoj odrasta i živi. Pri tome se primarno misli na kompleksna svojstva kao što su karakteristike naše osobnosti, no iako se o tome puno piše i istražuje, vrlo je malo toga opipljivog i egzaktnog do danas nesporno utvrđeno. Nije to ni čudno, jer se radi o svojstvima koja su najvjerojatnije kodirana velikim brojem gena od kojih svaki doprinosi relativno malo, te je teško izolirati i egzaktno utvrditi svaki pojedinačni doprinos. Iz istog razloga je teško i utvrditi preciznu granicu gdje prestaje biološka podloga a počinje doprinos okoliša. Ipak, sintagma “prirode nasuprot okoliša” se toliko uvriježila da pred njom vjerojatno malotko zastane i zapita se: a kako se to točno događa da okoliš utječe na našu biološku osnovu? No, čak i kad bismo se to zapitali, osobnost je, kako smo rekli, izrazito složeno svojstvo koje je teško vrlo detaljno i precizno definirati kvantitativnim parametrima, što bi bio nužni preduvjet za uspoređivanje pojedinih „tipova“ s biološkom nasljednom osnovom.
Ipak, okoliš sasvim sigurno utječe na nas i to ne samo na ovako kompleksna i gotovo nedokučiva svojstva organizama, već i na njihove puno elementarnije karakteristike, a takav utjecaj ipak možemo istraživati. Naravno, u pozadini ovog pristupa krije se ideja da, ukoliko na manje kompliciranom svojstvu uspijemo otkriti temeljne mehanizme utjecaja okoliša na genom, možda nam se posreći pa dio tih mehanizama dešifriramo i kod utjecaja na vrlo složena svojstva s početka ove priče.
Vjerojatno ste vidjeli sliku lijeve i desne strane lica vozača kamiona s dugogodišnjim stažem koja se često koristi kao primjer utjecaja štetnosti UV zraka. Iz ove je slike očito da lijeva strana lica pokazuje više znakova starenja u odnosu na desnu koja je bila manje izložena utjecaju sunca.
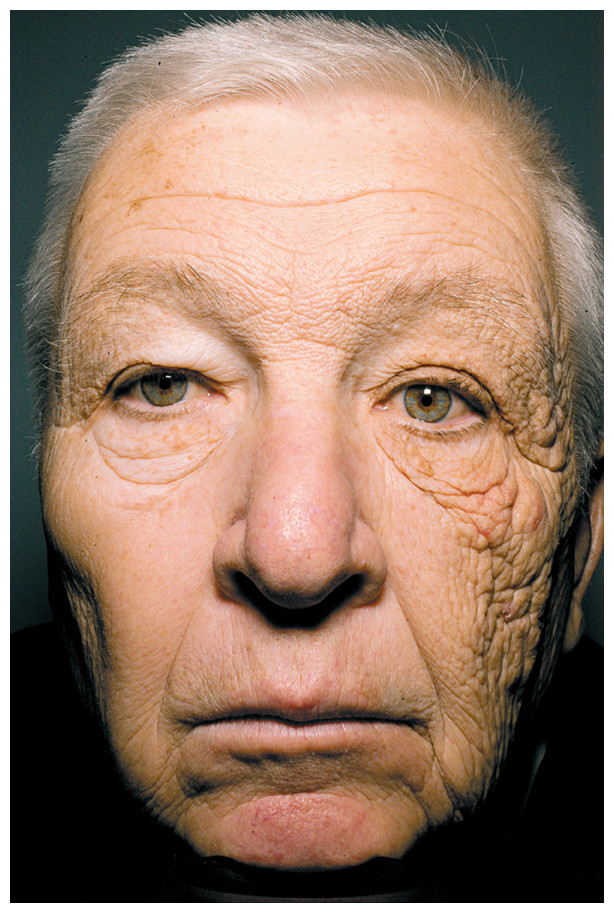
Ovo je također jedan od najdirektnijih mogućih primjera kako UV zrake, kao čimbenik okoliša, utječu na molekule DNA u stanicama te kolagen u koži i oštećuju je. Ta se oštećenja zatim dijelom uspijevaju popraviti, a dijelom ne. Time se u svakoj idućoj diobi stanica perpetuira ta greška u molekuli DNA i u konačnici (neki prije a neki kasnije) od bebine glatke kože dolazimo do naborane i smežurane kože u starosti. Neki nažalost i do melanoma i drugih tumorskih tvorbi na koži.
Ipak nisu svi utjecaji okoliša na nas tako ekstremni da izazivaju oštećenja molekule DNA. Okoliš uglavnom djeluje suptilnije, te izaziva promjene koje su većinom reverzibilne i ne zadiru u samu DNA, već u hijerarhiji regulacije djeluju na razini iznad samih gena tj. na regulaciji njihove aktivnosti ili, kako se to u struci još kaže, njihove ekspresije. Stoga ih nazivamo epigenetskim promjenama ili modifikacijama (grčki epi = iznad).
Sam pojam “epigenetika” datira još iz 1942. od znanstvenika Conrada Waddingtona, koji ga je prvi upotrijebio u kontekstu istraživanja uloge gena u razvojnoj biologiji. Nakon oplodnje, oplođena jajna stanica se dijeli i u početku su stanice koje nastaju sposobne sazreti (diferencirati se) u bilo koju od stanica organizma. Zapis koji nose je u svima ista informacija sadržana u molekuli DNA. No, kako se broj stanica povećava, počinje se uvoditi red u njihovu namjenu te se neke stanice usmjeravaju u stanice kože, druge u stanice mozga itd. Kako bi se to dogodilo, u određenoj stanici bit će aktivni samo oni geni koji su bitni da se ona usmjeri za neku funkciju, dok će drugi biti utišani. Tijekom embrionalnog razvoja višestaničnih organizama tako dolazi do niza aktivacija i inaktivacija gena koji kasnije, u životu odrasle jedinke, više ne moraju imati nikakvu funkciju. Uistinu, u diferenciranim stanicama odraslog organizma aktivno je svega 10-20% svih gena. „Paljenje i gašenje“ gena je u mehanističkom smislu rezultat epigenetskih modifikacija koje ne zadiru u sam zapis u DNA već u njegovu interpretaciju.
Do danas su najviše istražena tri osnovna mehanizma putem kojih nastaju epigenetske modifikacije a to su metilacija molekule DNA, modifikacija proteina histona te male nekodirajuće molekule RNA (ncRNA). Ovi mehanizmi sprečavaju da zapis u molekuli DNA bude „pročitan“ i iskorišten kao uputa te stoga zapravo djeluju tako da utišavaju aktivnost (ekspresiju) gena.
Prve dvije modifikacije direktno utječu na pakiranje molekule DNA u kompaktni oblik kromosoma te time utječu i na dostupnost zapisa u molekuli DNA enzimima u stanici koji taj zapis moraju pročitati. Prilikom metilacije na samu molekulu DNA dodaje se metilna skupina i na taj način je mjesto gdje se ona nalazi blokirano za daljnje prepisivanje u mRNA i protein. Histoni su proteini koji služe kao kalup za namatanje klupka molekule DNA u kompaktni oblik kromosoma. Time je omogućeno da se gotovo 2 metra molekule DNA upakira u jezgru koja je veličine 10 µm. Kompaktni oblik kromosoma je praktičan kod dioba stanica, jer se time olakšava prijenos genetskog materijala u novonastale stanice. No, kad se stanica podijeli, molekula DNA prelazi iz transportnog oblika u relaksiraniji oblik u kojem je više „razmotana“ te tako proteini stanične mašinerije koji moraju pročitati zapise mogu pristupiti i započeti s ekspresijom gena. Česta modifikacija histona je njihova acetilacija koja upravo relaksira to namatanje molekule DNA jer se naprosto acetilirani histoni ne mogu više tako kompaktno nagurati u klupko. U novije vrijeme otkriven je i treći mehanizam epigenetske regulacije putem nekodirajućih molekula RNA koje se vežu na sebi komplementarne zapise u molekuli mRNA (transkript koji nastaje čitanjem zapisa u molekuli DNA) te na taj način opet sprečavaju da informacija prepisana u molekulu mRNA bude dostupna staničnoj ekspresijskoj „mašineriji“ za daljnje prevođenje u protein (slika 2).
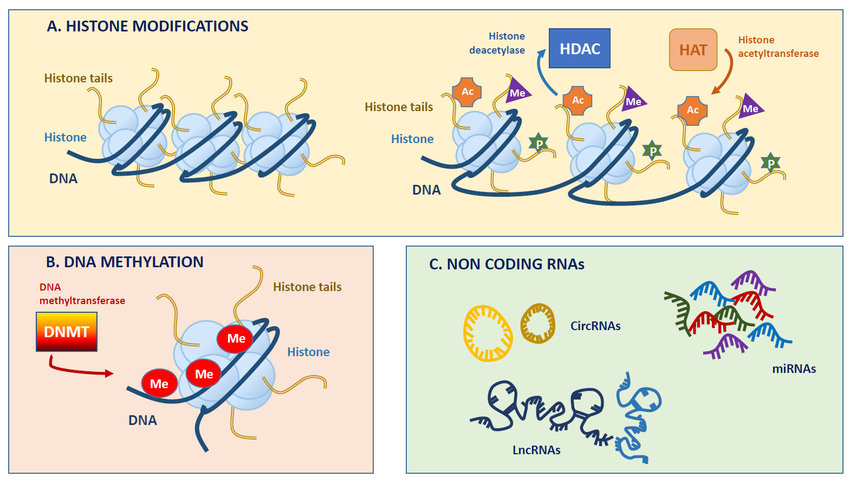
Svaka od ovih epigenetskih modifikacija može se „poništiti“ jer postoje mehanizmi, a zapravo se radi o sklopovima enzima, koji mogu napraviti reverziju ovih promjena na početno stanje. Ta reverzibilnost regulacije ekspresije gena omogućuje fleksibilnost u njihovoj aktivnosti te se geni mogu „paliti i gasiti“ ovisno o signalima koje dobivaju. To epigenetsku regulaciju čini vrlo pogodnim mehanizmom putem kojeg okoliš može djelovati na aktivnost gena a da ih nepovratno ne ošteti. U prvim diobama zigote ti signali dolaze od okolnih stanica, te majčinog organizma, no rođenjem postajemo direktno podložni i uvjetima vanjskog okoliša. Ne treba previše objašnjavati kako opstanak svakog živog bića ovisi o njegovoj prilagodljivosti okolišu u kojem se nalazi. Do te prilagodbe dolazi tijekom vremena u procesu evolucije i to su onda promjene koje su trajno zapisane u genom. No, živa bića se moraju prilagođavati okolišu svaki dan. Banalan primjer su prilagodbe poput debljanja mačaka pred zimu, kao i stvaranje zimskog krznenog ogrtača od dlake i poddlake koja se zatim linja u proljeće. Mačke koje žive stalno u zatvorenom to rade u puno manjoj mjeri. Radi se dakle o reaktivnim promjenama na uvjete okoliša.
Posebno je zanimljiv primjer određivanja spola kod barskih kornjača (E. oribicularis), ali i drugih gmazova u ovisnosti o temperaturi okoliša. Time se osigurava da se ženke koje će imati mlade rađaju samo u uvjetima koji su za to pogodni. Spol ovih kornjača naime ovisi o temperaturi na kojoj su jaja inkubirana. Pri “srednjim“ temperaturama (28.5°C) u leglu se mogu pronaći i ženske i muške jedinke, pri višim temperaturama (>30°C) sve jedinke su ženskog spola, a pri temperaturama nižim od 25°C sve jedinke su muškog spola. No, kako jaje „zna“ koja je temperatura okoliša, te koje gene treba upaliti i ugasiti? Kritični termosenzitivni period u kojem se promjenom temperature može utjecati na spol jedinki traje oko 2 tjedna u periodu od 28. – 52. dana razvoja jedinki. Danas znamo da u tom periodu dolazi do promjena u ekspresiji gena čija je aktivnost jača pri nižim temperaturama dok je suprimirana na višim temperaturama. Radi se većinom o transkripcijskim faktorima koji su bitni za pokretanje stanične mašinerije uključene u ekspresiju gena za determinaciju spola. No, koji su točno epigenetski mehanizmi na molekularnoj razini uključeni u ovu regulaciju nije još do kraja razjašnjeno te je ovo područje istraživanja određivanja spola kod gmazova prilično aktivno.
No promjene u okolišu nisu uvijek bezazlene, najbolji primjer za to je zagađenje zraka. Već je odavno prepoznato kako je ono povezano s različitim zdravstvenim problemima. U prvom redu se radi o bolestima dišnog sustava poput astme, kroničnog bronhitisa ali i neurodegenerativnim bolestima pa čak i karcinomima. Dapače, kako se ljudi polako odmiču od pušenja, zagađeni zrak sve više preuzima ulogu glavnog negativca. Tako je pokazano da ispušni plinovi automobila (specifično čestice PM2.5 i PM10) mogu utjecati upravo na acetilaciju histona i tako utjecati na aktivnost preko 400 gena. 1 Dodatno, pokazalo se kako i kratkotrajna i dugotrajna izloženost onečišćenju iz zraka izaziva promjene u metilaciji DNA. Na meti tako izmijenjene metilacije upravo su geni uključeni u popravak oštećenja molekule DNA (ERCC1, ERCC6, MGMT, hMLH1 i drugi).2
Još jedan od direktnih načina naše interakcije s okolišem je hrana. Ona je naše pogonsko gorivo i svakim zalogajem utječemo kako na trenutne tako i na dugoročne „performanse“ našeg organizma. Stoga i ne čudi da se istraživanje utjecaja hrane na epigenetske promjene s vremenom izdvojilo u zasebno područje – nutriepigenomike. Pokazalo se da međuodnos pojedinih makronutrijenata poput odnosa masti i ugljikohidrata u našoj prehrani također utječe na naš epigenetski status tj. na aktivnost gena te se u nekim istraživanjima također povezuje s nastankom metaboličkog sindroma. Također se pokazalo kako naša ovisnost o nekoj hrani može biti rezultat utjecaja specifičnih spojeva koji se u njoj nalaze te utječu na epigenetske mehanizme regulacije senzacija u našem mozgu.3
Tumorske bolesti rezultat su akumulacije mutacija u nizu onkogena i tumor-supresorskih gena. No uz mutacije, i epigenetski mehanizmi mogu utjecati na rad ovih gena. Istraživanje genetske podloge raka je, uz istraživanje embrionalnog razvoja, bilo među prvima u kojem su i potvrđeni epigenetski mehanizmi regulacije aktivnosti gena i to upravo onih za koje se smatralo da moraju ostati utišani nakon razvoja embrija u odraslu jedinku. Ono što je primijećeno jest da je jedna od glavnih karakteristika tumorskih stanica globalna hipometilacija DNA.4 Na taj način molekula DNA je labavije pakirana u kromosome pa mašinerija potrebna za aktivnost gena može lakše pristupiti onkogenima koji postaju aktivni. S druge pak strane, uz tumore je vezana i lokalizirana hipermetilacija (primjerice promotora, početnih dijelova gena koji su bitni za njihovo aktiviranje) tumor-supresorskih gena, čime se oni sprečavaju u svojoj aktivnosti. Također su u tumorima utvrđeni i drugačiji obrasci histonskih modifikacija u odnosu na zdravo tkivo.
U hrani se, uz makro- i mikronutrijente, također nalazi i niz bioaktivnih spojeva i toksina. Tako je pokazano da pojedine tvari u hrani mogu djelovati na metilacijski status a time na epigenetsku aktivaciju i inaktivaciju nekih onkogena i tumor-supresorskih gena. Stoga je intrigantna ideja da bi neke komponente hrane mogle imati protektivna svojstva kroz direktni utjecaj na epigenetski status ovih gena. Drugo područje u kojem bi epigenetska regulacija mogla imati bitnu ulogu su autoimune bolesti. Naime, u oboljelih od lupusa i artritisa također su utvrđeni izmijenjeni obrasci metilacije molekule DNA u njihovim T limfocitima.
Zasad je jedino što pouzdano pozitivno djeluje na epigenetski profil pojedinca zdrava prehrana te tjelesna aktivnost
Epigenetski status naših stanica zanimljiv je i u kontekstu istraživanja starenja budući da se niz promjena aktivnosti gena tijekom starenja povezuje upravo s epigenetskim mehanizmima regulacije. Kako su ove promjene reverzibilne prisutna je zasad kontroverzna ideja da bi se stoga ovi procesi mogli vratiti unatrag. Zasad je jedino što pouzdano pozitivno djeluje na epigenetski profil pojedinca zdrava prehrana te tjelesna aktivnost. Pokazalo se naime da osobe koje se pridržavaju zdravog životnog stila imaju bolji epigenetski status od osoba kod kojih to nije slučaj. Naravno, zasad nedosegnuti ideal bilo bi otkrivanje supstanci, tzv. senolitika koji bi procese starenja usporili ako ne i preokrenuli i u tom smjeru se danas provodi veliki broj komercijalnih istraživanja.
Opasnost reaktivacije aktivnosti gena koji bi nas učinili mlađima i poništavanja epigenetskog utišavanja jest u tome da se to upravo događa i u tumorskim stanicama koje se nekontrolirano dijele bez neke konačne diferencijacije za neku funkciju. Na taj način gotovo da perpetuiraju ono što se događa u prvim diobama našeg organizma, što nije čudno jer se u tumorskim stanicama često aktiviraju i geni koji su tijekom našeg embrionalnog razvoja trebali biti zauvijek utišani. Jesmo li i dalje sigurni da želimo uistinu podmladiti naše stanice? Ovo je pitanje na koje ćemo očito dobiti odgovor onda kada se neko od ovih istraživanja približi realnoj primjeni.
S obzirom na nature/nurture dihotomiju s početka teksta, možemo reći kako epigenetski mehanizmi regulacije ekspresije gena sudjeluju u ostvarivanju temeljnih funkcija stanica. Tijekom embrionalnog razvoja određuju njihovu specijalizaciju za određene namjene ali i kasnije tijekom života također prenose i utjecaj okoliša na regulaciju aktivnosti gena u stanici. Stoga će ovo klupko međusobnog utjecaja biti vrlo zahtjevno razmrsiti. No ukoliko se to dogodi barem parcijalno, već će i to otvoriti vrata novim putevima istraživanja koje danas nije moguće niti predvidjeti.
1) Dinga R i sur. (2016). H3K9 acetylation change patterns in rats after exposure to traffic-related air pollution. Environ Toxicol Pharmacol 42: 170-175.
2) Xu J i sur. (2022). Genetic damage and potential mechanism exploration under different air pollution patterns by multi-omics. Environ Int 170: 107636.
3) A. García-Blanco i sur. (2022). miRNA signatures associated with vulnerability to food addiction in mice and humans.J Clin Invest. 132(10):e156281
4) Feinberg AP i Vogelstein, B (1983). Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature 301: 89-92