NOBELOVA NAGRADA ZA MEDICINU I FIZIOLOGIJU 2023
Karikó i Weissman. Nobel za modifikaciju nukleozidnih baza. Početak ere munjevitih razvoja cjepiva
 Tamara Čačev / 2. listopada 2023. / U fokusu / čita se 11 minuta
Tamara Čačev / 2. listopada 2023. / U fokusu / čita se 11 minuta

 Tamara Čačev / 2. listopada 2023. / U fokusu / čita se 11 minuta
Tamara Čačev / 2. listopada 2023. / U fokusu / čita se 11 minuta

Brzina kojom su nakon pojave COVID-19 pandemije razvijena mRNA cjepiva zatekla je sve koji nisu pratili razvoj modernih tehnologija na ovom području, piše Tamara Čačev u tekstu posvećenom ovogodišnjoj Nobelovoj nagradi za medicinu i fiziologiju. Istraživanja Karikó i Weissmana, zajedno s razvojem učinkovitih sustava za dopremanje mRNA u stanice, omogućila su da cjepiva protiv SARS-CoV-2, ali i sva buduća cjepiva koja će nam hitno trebati, možemo razviti u iznimno kratkom roku.
Nobelova nagrada za Fiziologiju ili medicinu dodjeljuje se od 1901. godine i od tada ih je dodijeljeno 113 pri čemu je najmlađi dobitnik imao 32 godine (F.B. Banting, 1923., otkriće inzulina) a najstariji 87 godina (P.Rous, 1966., virusi koji uzrokuju tumore). Zanimljivost je da su s odmakom od 40 godina nagradu za medicinu dobili otac i sin (S. Bergström, 1982. , prostaglandini i S.Pääbo, 2022., genom Neandertalca). U ovom periodu svega je 12 žena dobilo ovu prestižnu nagradu i to većinom počevši od kraja 70-tih uz izuzetak G.Cori koja je nagradu dobila 1947. godine zajedno sa suprugom.
Ove godine laureati su Katalin Karikó kao trinaesta žena u ovom nizu te Drew Weissman koji su ovu prestižnu nagradu dobili za istraživanja modifikacija nukleozidnih baza u nukleinskim kiselinama koja su dovela do brzog razvoj učinkovitih mRNA cjepiva protiv SARS-CoV-2 odnosno bolesti COVID-19. Područje razvoja cjepiva, uz otkriće antibiotika, jedno je od najznačajnijih za napredak naše vrste jer nam je omogućilo da preživimo i značajno produžimo životni vijek. Od prvotnih „vakcinacija“ prijenosom male količine uzročnika boginja s oboljelog na zdrave još iz doba Katarine Velike do danas prijeđen je veliki put najprije u klasičnoj imunologiji a zatim i molekularnoj biologiji. Napredak u ovim područjima omogućio nam je da za COVID-19 razvijemo cjepivo najbrže u ljudskoj povijesti. Skeptici će reći kako nije bilo dovoljno testirano, iako danas nakon oko 13 milijardi administriranih doza možemo reći kako je ovaj argument postao irelevantan. Drugi će reći kako je učinkovitost i trajnost cjepiva kratka, no ono što nitko do sada nije osporio jest da je spasilo život mnogim najugroženijim skupinama oboljelih od kroničnih i malignih bolesti svih životnih dobi te naših najstarijih od kojih je mnogima cjepivo napravilo razliku između života i smrti. Stoga se cjepivo protiv SARS-CoV-2, kojeg sam se višekratno dotakla u svojim tekstovima za Ideje, stvarno može smatrati jednim od većih uspjeha molekularne biologije i to ne samo kao rješenje trenutne pandemije nego i kao temelj budućih cjepiva protiv zaraznih, ali potencijalno i malignih bolesti.
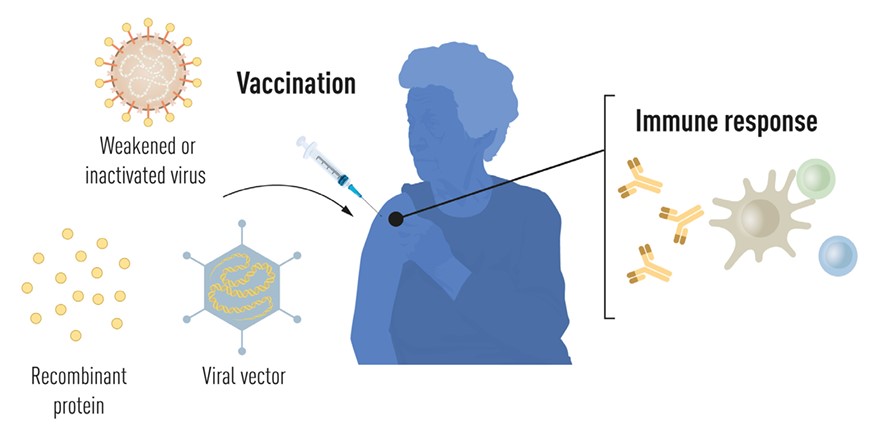
Prvotna cjepiva protiv virusnih uzročnika bolesti dobivala su se, danas možemo reći – tradicionalnim metodama, koje su se temeljile na oslabljivanju virusa kroz pasaže ili kemijskoj/termičkoj inaktivaciji cijele virusne čestice. Ona se i danas smatraju iznimno dobrim cjepivima koja potiču dugotrajni imunološki odgovor te se stoga većinom protiv bolesti kao što su rubela, ospice ili mumps cijepimo u dječjoj dobi. Razvoj cjepiva već dugo ne ovisi o umrtvljenom uzročniku zarazne bolesti kao agensu na koji ćemo razviti protutijela kako bi se pri nekom kasnijem susretu mogli od njega uspješno obraniti. Danas se u konstrukciji cjepiva koriste samo pojedini „dijelovi“ mikroorganizma koji se dobiju biotehnološkim manipulacijama. Takvi mali komadići mikroorganizma nisu sposobni izazvati bolest ali mogu izazvati reakciju imunološkog sustava da razvije mehanizme prepoznavanja za slučaj susreta s pravim uzročnikom bolesti. Danas zapravo koristimo dijelove koda iz genoma primjerice nekog virusa kao što je to SARS-CoV2, i to obično onog dijela koji kodira za neki protein na površini virusa. U slučaju SARS-CoV2 radilo se o proteinu Spike (šiljak), ali ovaj princip primijenjen je i na cjepiva protiv hepatitisa B (1986.) ili HPV-a (2006.). Ponekad se takvi kodirajući fragmenti ugrade u tzv. vektore, kako ih nazivamo u molekularnoj biologiji, a radi se obično o plazmidima, cirkularnim molekulama DNA, koje relativno lako ulaze u stanice gdje se onda iz koda kojeg nose sintetizira fragment nekog proteina virusa koji će izazvati imunosni odgovor. U svim ovim primjerima još uvijek moramo imati fazu uzgoja virusa ili vektorskih mikroorganizama u staničnim kulturama što dodaje značajni vremenski period i troškove na proces proizvodnje cjepiva.
Ideja o mRNA cjepivima odnosno bolje reći cjepivima temeljenim na nukleinskim kiselinama nije nova. Smatralo se kako bi se takva cjepiva lakše i brže proizvodila i modificirala jer bi trebalo samo malo izmijeniti kod u nukleinskoj kiselini te bi se sve odvijalo bez potrebe uzgoja u kulturama. Dodatno, ovaj bi tip cjepiva uz aktivaciju uobičajenih elemenata imunološkog sustava kojeg aktiviraju i druga cjepiva aktivirao i citotoksične CD8+ T limfocite što se smatralo bitnim za razvoj cjepiva protiv meta na tumorskim stanicama. No mRNA cjepiva nisu zaživjela prvenstveno zbog inherentne nestabilnosti molekule mRNA te drugih problema vezanih uz njenu kliničku primjenu. Laički rečeno, mRNA je bila iznimno nepraktična od proizvodnje do njene distribucije i potencijalne kliničke aplikacije. Ako se prisjetimo COVID-19 cjepiva, znamo da se ona moraju čuvati na izrazito niskim temperaturama u posebnim ledenicama te transportirati pod specijalnim uvjetima upravo zbog te krhkosti čestica koje sadrže mRNA. Stoga je prvotni fokus istraživanja cjepiva temeljenih na nukleinskim kiselinama bio na molekuli DNA budući da je ona stabilnija od mRNA, no napredak nije postignut jer ove molekule moraju proći kroz membranu stanice i jezgre gdje se DNA prepisuje u molekulu mRNA. Za razliku od DNA, molekule mRNA imaju svoju funkciju u citoplazmi stanice te stoga ne moraju prelaziti jezgrinu membranu. Također, smatra se kako se mRNA ne može integrirati u genom domaćina te se stoga njihovo uvođenje u kliničku primjenu smatra iznimnim doprinosom vrijednim Nobelove nagrade.
Katalin Karikó, biokemičarka je mađarskog porijekla koja je svoju karijeru započetu 90-tih u SAD-u gdje se posvetila razvoju metoda kojima bi se mRNA modificirala tako da može biti dovoljno stabilna za primjenu u terapiji. Na Sveučilištu u Pennsylvaniji upoznala je i počela surađivati s imunologom Drewom Weissmanom koji je istraživao kako stanice imunološkog sustava reagiraju na različite molekule RNA. Ubrzo su uočili kako posebna vrsta imunosnih stanica, dendritičke stanice, prepoznaju molekule mRNA sintetizirane u laboratoriju kao strane. To izaziva aktivaciju dendritičkih stanica te otpuštanje protuupalnih molekula. Postavilo se pitanje, zašto ove stanice in vitro sintetiziranu molekulu mRNA prepoznaju kao stranu, kad u svakoj stanici imamo na stotine tisuća mRNA. Zaključili su kako mora postojati neko obilježje molekula mRNA koje su nativne i sintetizirane u stanici sisavca u odnosu na one sintetizirane u laboratoriju.
Karikó i Weissman bacili su se na istraživanje modifikacija nukleozidnih baza kako bi pronašli one koji neće izazvati aktivaciju dendritičkih stanica
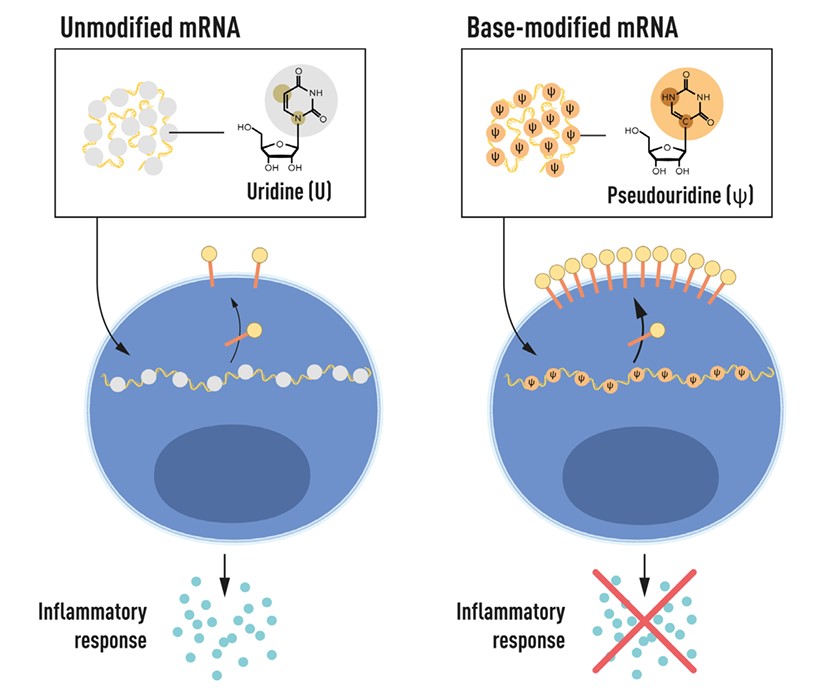
Dendritičke stanice na svojoj površini imaju posebne TLR receptore koji prepoznaju specifične molekularne strukture koje nazivamo PAMPs a radi se o svojevrsnim molekularnim „uzorcima“ patogena. Kada TLR receptor prepozna takav uzorak pokreće se proizvodnja protuvirusnih citokina kako bi se cijeli organizam upozorio na prodor patogena. Jedan od ključnih uzoraka koji se prepoznaje je nemetilirana sekvenca CpG u nukleinskim kiselinama koja je česta u mikroorganizmima no kod sisavaca je rijetkost. Svaka molekula RNA u stvari je niz koji se sastoji od četiri nukleotida adenina (A), uracila (U), gvanina (G) te citozina (C). Oni se u molekulu RNA ugrađuju prema uputama dobivenim iz koda koji je zapisan u molekuli DNA. Već je otprije bilo poznato kako ove nukleozidne baze mogu u stanicama sisavaca biti kemijski modificirane. Ove modifikacije nadodaje stanična mašinerija koje nema u uvjetima sinteze molekule RNA in vitro. Stoga su se Karikó i Weissman bacili na istraživanje upravo tih kemijskih modifikacija nukleozidnih baza kako bi pronašli one koje neće izazvati aktivaciju dendritičkih stanica.
To je istraživanje urodilo publikacijom 2005. godine i već tada je bilo jasno kako će predstavljati prekretnicu u razmišljanju o korištenju molekula RNA u razvoju različitih terapija budući da se modifikacijom nukleozida može doći do molekula koje neće stimulirati imunološku reakciju. Pokazali su naime kako eukariotska mRNA i tRNA imaju puno ovih modifikacija te stoga ne izazivaju citokinski odgovor, dok prokariotske i in vitro sintetizirane mRNA i tRNA to nemaju te ih stoga viši organizmi s razvijenim imunosnim sustavom smatraju stranim i eliminiraju. Ako se u sintetske mRNA ugrade pseudouridin (Y), 5-metilcitidin (m5C), N6-metiladenozin (m6A), 5-metiltilurdin (m5U) ili 2-tiouridin (s2U) tada ne dolazi do poticanja upalnog odgovora. Ugradnja m6A ili s2U tako onemogućava receptor TLR3 da prepozna sintetsku mRNA dok ugradnja m6A, s2U, m5C, m5U te Y onesposobljava receptore TLR7 i TLR8. Do danas je otkriveno na stotine modifikacija baza u eukariotskoj mRNA no njihova fiziološka uloga nije ni približno razjašnjena. Kao bitna za odgovor dendritičkih stanica na sintetsku mRNA pokazala se deaminacija uridina u molekuli RNA.
Kasnijim publikacijama (2008. i 2010.) ovogodišnji dobitnici Nobelove nagrade pokazali su da modifikacije baza N1-metilpseudouridin samostalno ili u kombinaciji s 5-metilcitidinom u mRNA također mogu izazvati i pojačanu proizvodnju proteina u stanici jer se tako modificirana mRNA dulje zadržava na ribosomima, tvornicama proteina u stanici. Ovo smatra poželjnim svojstvom za razvoj cjepiva jer i jest cilj da se prijespomenuti fragmenti nekog mikroorganizma proizvedu unutar stanica u količini koja će stimulirati imunološki odgovor na točno tu metu. Upravo je ova modificirana baza i korištena u razvoju cjepiva protiv SARS-CoV-2. Time su zapravo riješili dvije ključne prepreke za kliničku primjenu cjepiva temeljenih na mRNA. Znanstvenici u ovom području odmah su preuzeli rezultate ovih studija te su osnovane i kompanije koje su nam danas poznate kao proizvođači cjepiva protiv korone: CureVac osnovan 2000. s ciljem razvoja cjepiva protiv zaraznih i tumorskih bolesti, svima poznati BioNTech iz kojeg dolazi i Karikó koji je osnovan 2008. s primarnim ciljem u razvoju personaliziranih cjepiva protiv raka te Moderna osnovana 2010. s ciljem reprogramiranja tjelesnih stanica u pluripotentne iz kojih se mogu razviti sve vrste stanica. CureVac je dao doprinos u optimizaciji procesa produkcije proteina u stanici na temelju sintetske mRNA te u poboljšanju metoda unosa mRNA u stanice. Ova je tvrtka razvila i prvo eksperimentalno cjepivo, bolje reći terapiju protiv melanoma koja se temelji na stimulaciji imunosnog sustava da reagira na specifične markere tumorskih stanica koji se nalaze na njihovoj površini. Moderna je dala doprinos u razvoju cjepiva protiv Zika virusa i MERS-CoV te su upravo spoznaje iz razvoja cjepiva za potonji virus bile od velike koristi za razvoj cjepiva protiv SARS-CoV-2 jer se radi o srodnim virusima.
Svi ovi prethodni napori omogućili su da se razviju cjepiva protiv SARS-Cov-2 temeljena na mRNA tehnologiji te su i odobrena u rekordnom roku već u prosincu 2020.
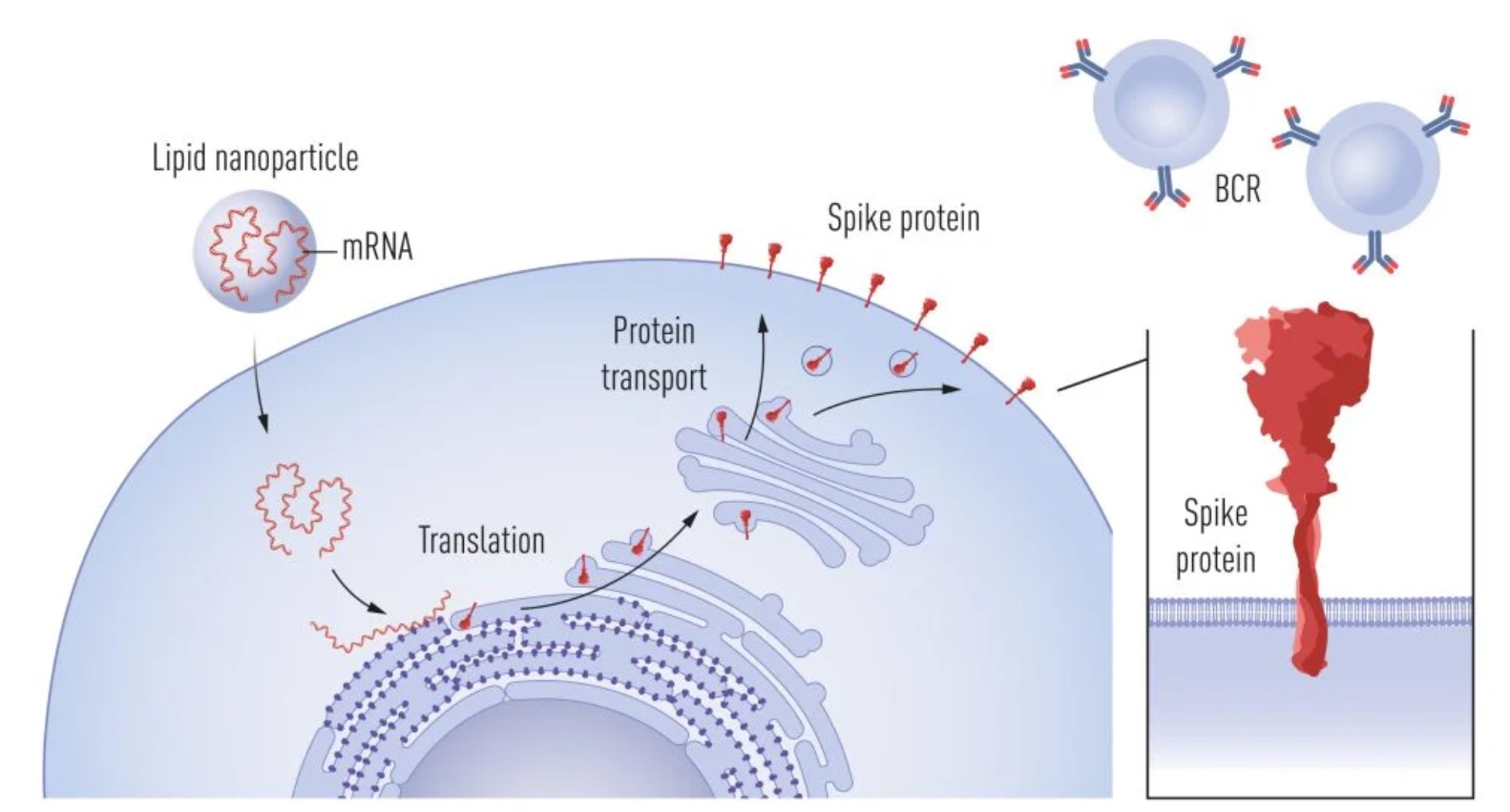
Ovakva brzina bez presedana zatekla je one koji nisu pratili što se događa na području razvoja cjepiva pa su se mogle čuti i razne izjave o potrebi dugotrajnih testiranja i dugog procesa proizvodnje ovih cjepiva upravo zbog nerazumijevanja i nepraćenja modernih tehnologija u ovom području. Slično kao kada danas pitate nekoga tko površno prati područje što zna o mogućnostima umjetne inteligencije, koja je također korištena u razvoju ovih cjepiva te je omogućila da se predvidi trodimenzionalna struktura mete koja je najpogodnija za cjepivo. Čak su i stručnjaci iz šire sfere interesa bili pomalo zatečeni ovom brzinom. No, ta brzina nije bila ishitrenost već naprosto rezultat enormnog napretka u molekularnoj biologiji u području koje je dotad pomalo bilo i zanemarivano pogotovo u kontekstu sveopćeg antivakserskog ludila čije učinke možemo vidjeti i u recentnoj revitalizaciji hripavca u nas.
Otkrića ovo dvoje znanstvenika udruženo s razvojem učinkovitih sustava za dopremanje mRNA u stanice (lipidne nanočestice), za koje možda također bude dodijeljena Nobelova nagrada, možda iz kemije (no to ćemo tek vidjeti) a poduprto ogromnim sredstvima iz javnog i privatnog sektora omogućilo je da se cjepivo protiv SARS-CoV-2 ali i sva buduća cjepiva koja će nam neminovno kad-tad zatrebati razviju u iznimno kratkom roku. Ovakav real-time doprinos nekog znanstvenog otkrića na globalnoj skali u životima svakoga od nas nismo imali prilike dosad vidjeti. Ovakvi primjeri daju nam vjeru u neuništivost ljudskog uma ako nas ne poklopi mrak autodestrukcije u vidu ratova i odbijanja prihvaćanja civilizacijskih dostignuća poput cjepiva.
Katalin Karikó rođena je 1955. godine u Szolnoku u Mađarskoj. U domovini je završila cjelokupno obrazovanje te doktorirala 1982. godine. Kao postdoktorand pri Mađarskoj akademiji znanosti započela je svoju karijeru u SAD 1985. godine na Sveučilištu u Pennsylvaniji na kojem je radila do 2013. godine. Nakon toga je prešla u privatni sektor te je postala direktorica BioNTech RNA Pharmaceuticals, tvrtke koja je zaslužna za proizvodnju mRNA cjepiva protiv SARS-CoV-2.
Drew Weissman rođen je 1959. godine u Lexingtonu u SAD. Završio je Medicinski fakultet te doktorirao pri Sveučilištu u Bostonu 1987. godine. Radio je Beth Israel Deaconess Medical Center pri Harvard Medical School te kao postdoktorand pri National Institutes of Health. Od 1997. godine zaposlen je na Sveučilištu u Pennsylvaniji gdje radi kao profesor te direktor instituta za inovacije u području RNA.
Znanstveni radovi u kojima su prikazani rezultati za koje je dobivena Nobelova nagrada za fiziologiju ili medicinu:
1) Karikó, K., Buckstein, M., Ni, H. and Weissman, D. Suppression of RNA Recognition by Toll-like Receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity 23, 165–175 (2005).
2) Karikó, K., Muramatsu, H., Welsh, F.A., Ludwig, J., Kato, H., Akira, S. and Weissman, D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 16, 1833–1840 (2008).
3) Anderson, B.R., Muramatsu, H., Nallagatla, S.R., Bevilacqua, P.C., Sansing, L.H., Weissman, D. and Karikó, K. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. 38, 5884–5892 (2010).