Nobelova nagrada za kemiju 2019
Svijet na punjenje. Desetljeća usavršavanja litij-ionskih baterija, bez kojih bi suvremeni način života bio nemoguć.
 Igor Rončević / 23. listopada 2019. / Članci / čita se 9 minuta
Igor Rončević / 23. listopada 2019. / Članci / čita se 9 minuta

 Igor Rončević / 23. listopada 2019. / Članci / čita se 9 minuta
Igor Rončević / 23. listopada 2019. / Članci / čita se 9 minuta

Naslovi poput: „Njemačka za sunčanog i vjetrovitog dana proizvela 100% svoje potrebe za energijom iz obnovljivih izvora“ su bezrazložno dramatični ako se ta energija ne može nekako pohraniti, piše Igor Rončević u članku u kojem objašnjava kroz koje su faze ovogodišnji nobelovci za kemiju razvijali litij-ionske baterije koje pohranjuju energiju i omogućavaju suvremeni način života
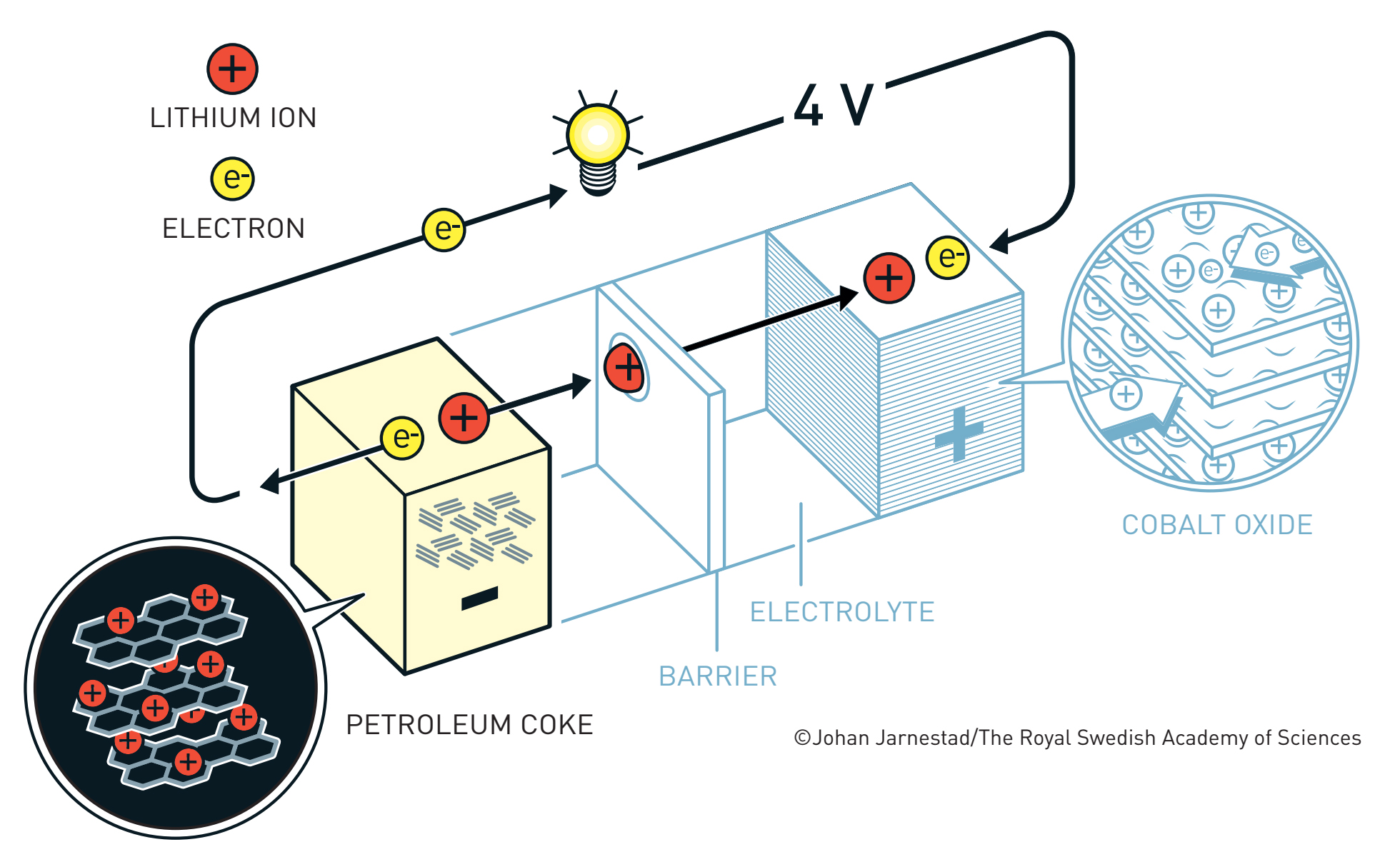
Današnji užurbani, uvijek online način života ne bi bio moguć bez litij-ionskih baterija koje pogone naše mobitele i tablete, fotoaparate i laptope, a polako i automobile. Uz to, one su nužne za efikasno korištenje obnovljivih izvora energije. Za razvoj tih punjivih i energetski gustih baterija, John Goodenough, Stanley Whittingham, i Akira Yoshino dobili su ovogodišnju Nobelovu nagradu iz kemije.
Početkom svakog listopada, Američko kemijsko društvo predviđa dobitnike Nobelove nagrade za kemiju.(1) Ovogodišnja predviđanja bila su podijeljena između pionira relativno nove CRISPR-CAS tehnike, o čemu smo već pisali (2) te Johna Goodenougha, veterana litij-ionskih baterija. Goodenough je nagradu i dobio, te tako u 97. godini života postao najstariji laureat Švedske akademije.
No, priča o litij-ionskim baterijama je još starija: počinje 1913. godine, kada je Lewis (čije se strukture sa crticama i točkicama uče u srednjoj školi) odredio elektrodni potencijal tada relativno novog metala litija.(3) Pokazalo se da se litij izuzetno lako oksidira, odnosno gubi elektrone.(4) U kombinaciji sa njegovom vrlo malom gustoćom (dvostruko manjom od vode i čak petnaest puta manjom od željeza), veliki oksidacijski potencijal činio je litij izvrsnim materijalom za baterijske anode – u teoriji.
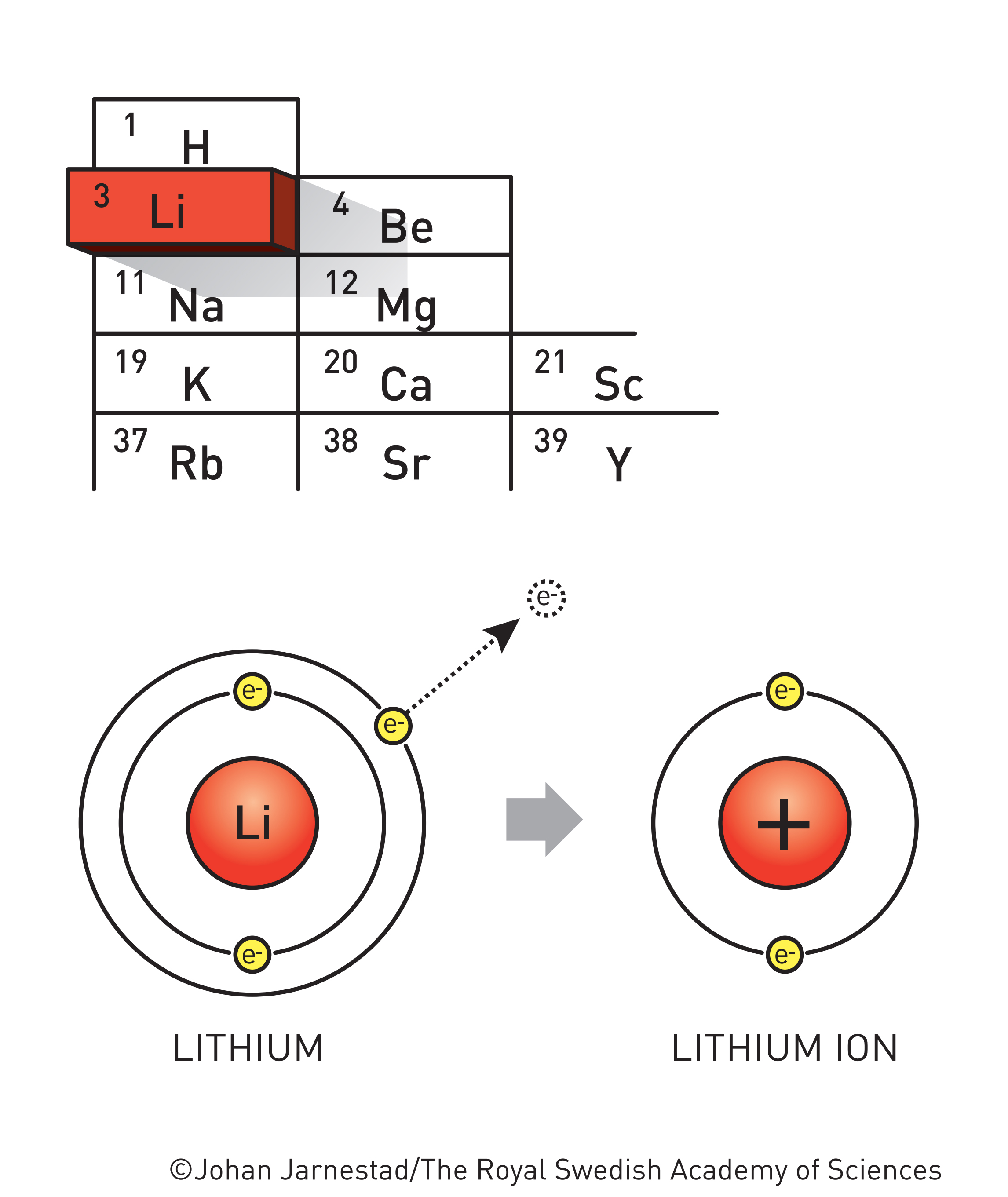
Za primjenu litija u prvim punjivim baterijama trebalo je pričekati više od pola stoljeća. Litijeva osnovna prednost (veliki oksidacijski potencijal) ujedno je bila i velika prepreka – trebalo je spriječiti reakcije sa zrakom, elektrolitom (voda i kiseline nisu dolazile u obzir) i kućištem baterije. Do sedamdesetih godina prošlog stoljeća ti problemi su većinom bili riješeni, no i dalje nije bilo jasno što će biti katoda, odnosno kuda će litijevi ioni ići nakon oksidacije.
Naftna kriza 1973. motivirala je mnoge firme za ulaganje u alternativne izvore i nove načine pohrane energije. Tadašnji Exxon se zainteresirao za baterije bazirane na litiju, i doveo Stanleya Whittinghama na čelo razvojnog tima. Na temelju svojih prošlih iskustava (5) Whittingham je imao izvrsnu ideju za katodu (multidisciplinarnost na djelu!).
U ljeto, kada zatopli i dani se produže, milijuni ljudi bukiraju godišnje odmore i plaćaju velik novac da bi otišli u apartmane i hotele u planinama ili na moru, samo da se maknu iz ureda i gradske vreve. Kada godišnji prođe, a novac se potroši, nevoljko se vraćaju kući na posao.
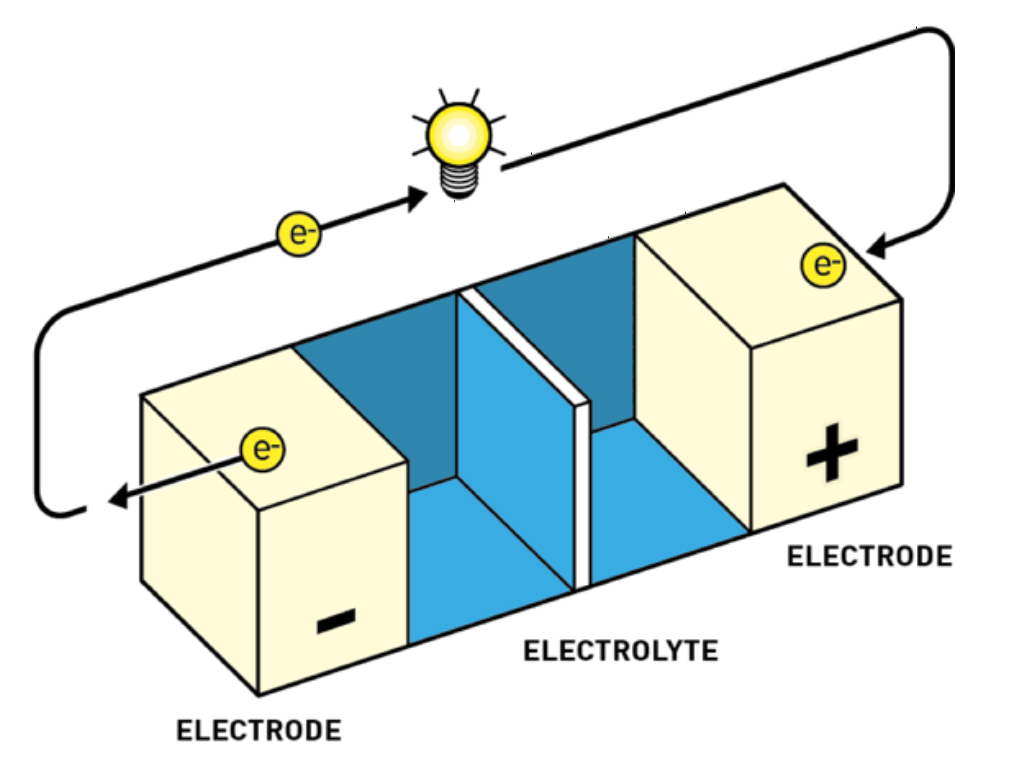
Prije rada na baterijama, Whittingham je istraživao fenomen interkalacije (smještaja) iona u šupljine prisutne u kristalnim strukturama raznih materijala, na primjer titanijeva disulfida. Zanimljivo je da su interkalirani metali vrlo zadovoljni svojim smještajem, pa je Whittingham došao na ideju da napravi bateriju u kojoj litij iz nezadovoljnog stanja velikog potencijala (metal na anodi) prelazi u zadovoljno interkalirano stanje (na katodi) nižeg potencijala, pritom plaćajući svojim elektronima (pogoneći strujni krug) baš kao i mi kad idemo na godišnji.

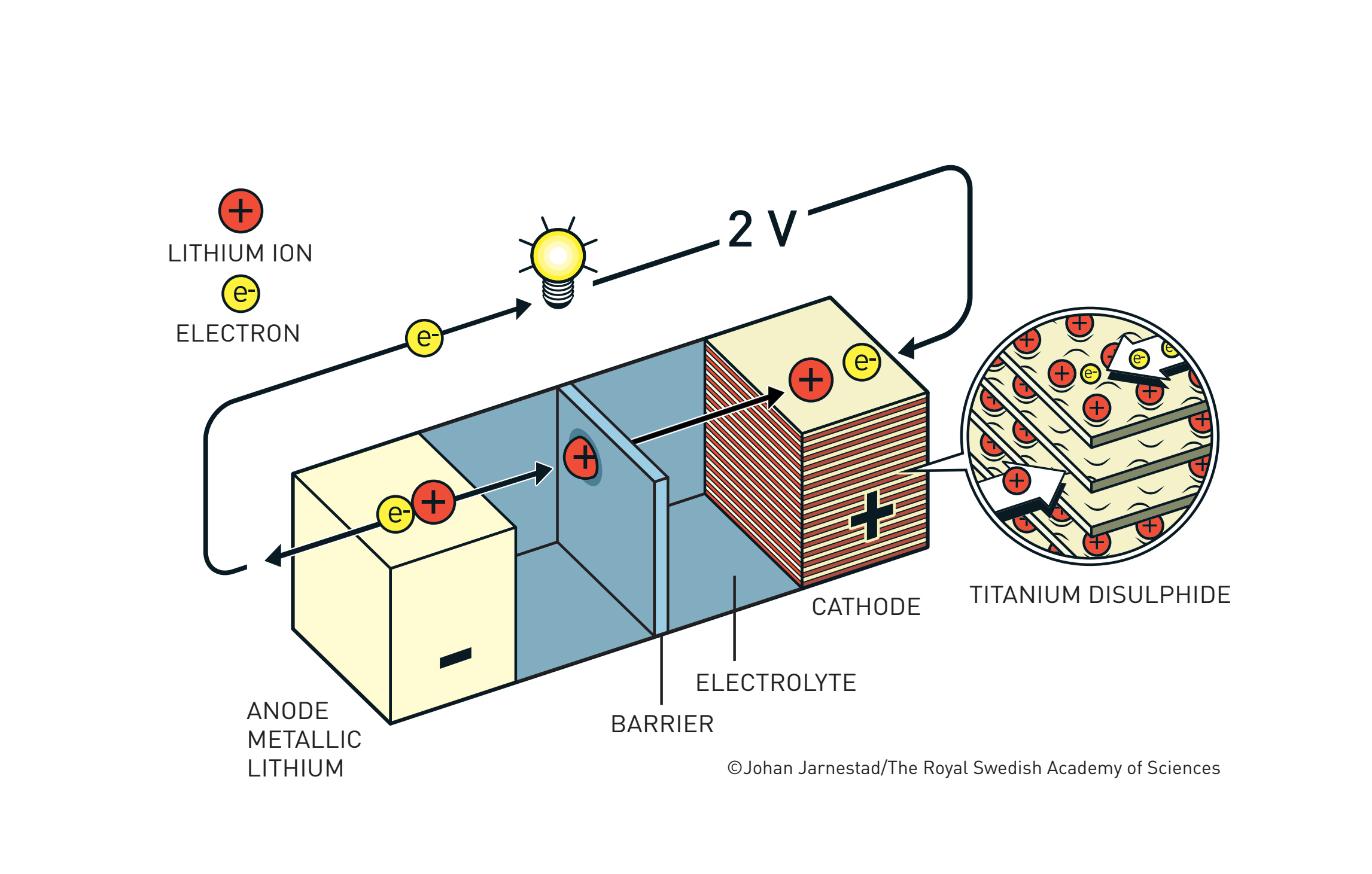
Whittinghamova baterija je funkcionirala: razvijala je napon nešto veći od 2 volta i mogla je izdržati više od tisuću ciklusa punjenja i pražnjenja bez značajnog gubitka u kapacitetu. Međutim, korištenje metalnog litija uzrokovao je probleme: Whittinghamove baterije bile su toliko sklone samozapaljenju da je lokalna vatrogasna služba uvela posebne tarife za gašenje požara uzrokovanih litijem! Također, napon od 2 volta bio je relativno malen, tako da je evolucija litij-ionskih baterija tekla kroz poboljšanje i katode (povećanje napona) i anode (smanjenje eksplozivnosti).
Krajem sedamdesetih, naftna kriza je prošla i Whittinghamov laboratorij je ugašen. Međutim, laboratorij Johna Goodenougha na Oxfordu nastavio je proučavati interkalaciju litija s ciljem razvoja bolje katode. U tome su i uspjeli 1980. godine, kada su pokazali kako je kobaltov dioksid daleko bolji materijal od titanijeva disulfida, razvijajući napon od gotovo 4 volta uz 500 puta veću mobilnost litijevih iona.(6) Nastavak priče prilično je nezgodan – nakon tog otkrića jedan od Goodenoughovih studenata vratio se u Japan, da bi Sony 1991. započeo masovnu proizvodnju litij-kobaltov dioksid baterija, usprkos Goodenoughovom patentu iz 1982. Uslijedila je duga pravna bitka iz koje Goodenough nije puno profitirao, no to ga nije obeshrabrilo – kroz osamdesete i devedesete nastavio je razvijati nove vrste katoda.(7,8) 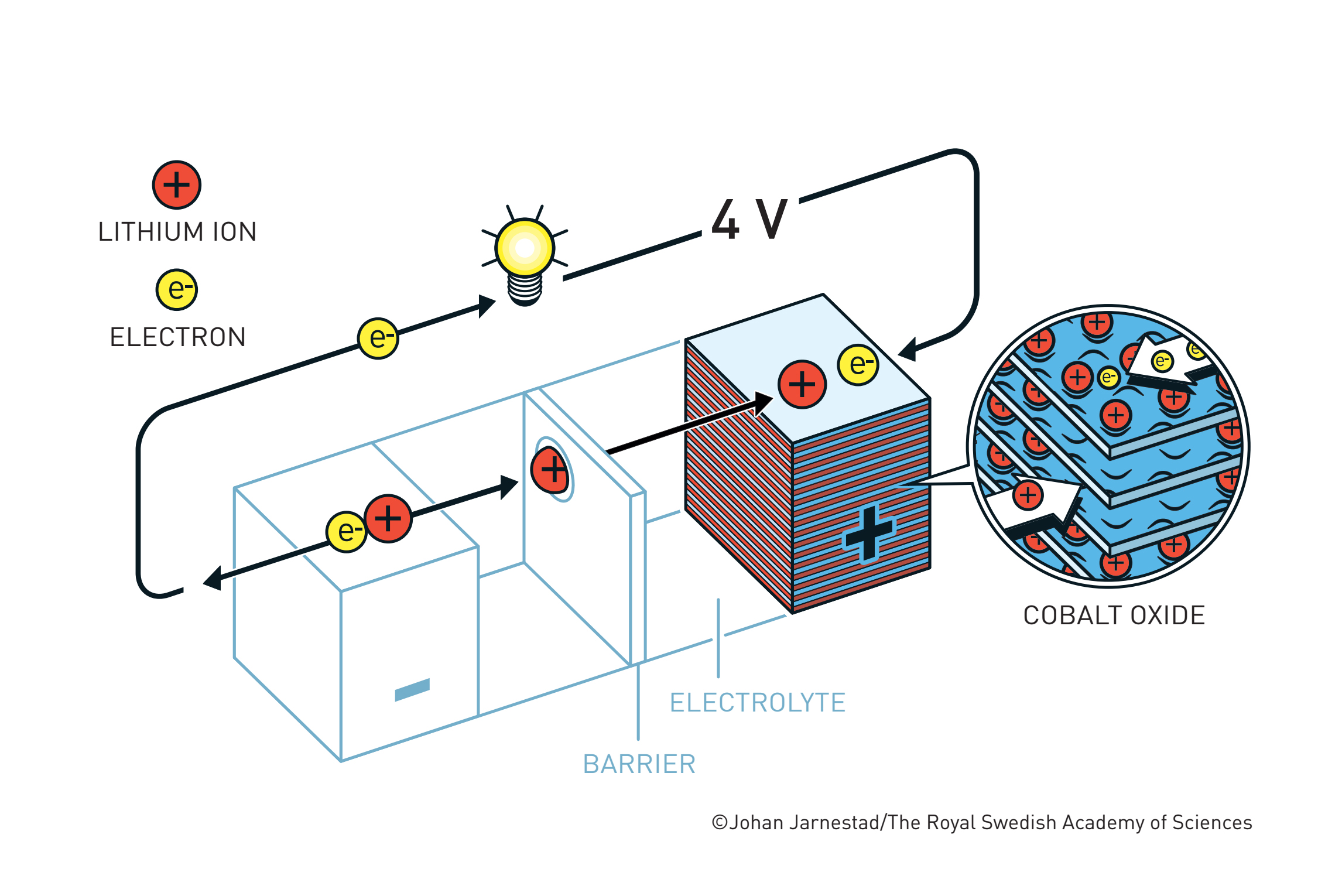
Goodenoughovim otkrićem početkom osamdesetih problem napona bio je riješen, no problem eksplozivnosti uzrokovan korištenjem metalnog litija na anodi i dalje je bio velika prepreka ka primjeni litij-ionskih baterija. Akira Yoshino je imao ideju da interkalira i litij na anodi, no to nije bilo vrlo jednostavno. Interkalacija litiju smanjuje potencijal (čini ga zadovoljnijim, manje zainteresiranim za plaćanje i odlazak na ljetovanje), tako da je trebalo pronaći materijal koji će spriječiti eksplozivnost uz minimalan gubitak potencijala. Taj materijal bio je posebno pripremljen naftni koks (a kasnije i grafit), u kojem litij ima svega 0.2 volta slabiji potencijal nego u čistom metalu. Yoshino je svoje rezultate objavio 1985.(9) čime su konačno postavljeni temelji moderne litij-ionske baterije.
Svi vole netaknutu prirodu, ili zašto baterije gube kapacitet
Ako već dugi niz godina ljetujete na istom mjestu, zasigurno ste primijetili kako se ono promijenilo: broj apartmana i turista povećava se iz godine u godinu, pa ni ulice ni plaže ne izgledaju isto. Netaknuta i divlja priroda sa starih fotografija jednostavno ne može koegzistirati sa masovnim turizmom – nakon što turisti nekoliko puta dođu i odu, za sobom neće ostaviti mjesto u istom stanju u kojem je ono bilo, a ostavit će traga i na prilaznim cestama.
S baterijama je stvar vrlo slična: preveliko pražnjenje (selidba previše litijevih iona) drastično povećava šansu narušavanja kristalne strukture u koju se oni interkaliraju, što u konačnici smanjuje kapacitet baterije. Povećanje temperature, primjena prevelikog napona (brzo punjenje) i osobito pritisak također povećavaju šansu nastanka defekata u kristalnoj strukturi. Također, elektrolit kojim ioni putuju od elektrode do elektrode se polako troši.
Danas, razvoj novih baterija vrlo je živahna disciplina na granici znanosti i tehnologije. Iako smo u svakodnevnom životu okruženi punjivim baterija, ogromna većina danas korištenih baterija su i dalje jednokratne, što je velik problem zbog njihovog zbrinjavanja.(10) Međutim, cijena punjivih litij-ionskih baterija dramatično se smanjuje, sa 1176 $/kWh u 2013. na samo 176 u 2018.(11) čineći ih sve privlačnijima.
Osim primjene u elektronici te hibridnim i električnim autima, stabilne i jeftine baterije velikog kapaciteta nezamjenjiv su dio bilo kakve električne mreže koja se temelji na obnovljivim izvorima energije. Naslovi poput: „Njemačka (za vrijeme vjetrovitog i sunčanog dana, op.a.) proizvela 100% svoje potrebe za energijom iz obnovljivih izvora“(12) su bezrazložno dramatični ako se ta energija ne može nekako pohraniti (što ćemo kad padne noć i nema vjetra?). Intrinzičnu nepouzdanost solarnih panela i vjetroelektrana moguće je prevladati samo ako cijena pohrane velike količine električne energije postane zanemarivo mala (u usporedbi s cijenom njene proizvodnje), a litij-ionske baterije napravile su ogroman iskorak na putu do tog cilja.
I za kraj, poslušajte reakciju 97-godišnjeg Johna Goodenougha na vijest da je dobio Nobelovu nagradu:
Kronologija nastanka litij-ionskih baterija
1817. – Johan August Arfwedson i Jöns Jakob Berzelius otkrivaju litij, najlakši poznati metal.
1913. – Gilbert Lewis mjeri elektrodni potencijal litija.
1958. – William Harris brani doktorat na temu organskih elektrolita koji se mogu koristiti u elektrodama s alkalijskim metalima (litijem, natrijem…).
1976. – Stanley Whittingham konstruira prvu (eksplozivnu) litij-ionsku bateriju, s katodom od titanijeva disulfida i anodom od metalnog litija.
1980. – John Goodenough predstavlja katodu na bazi kobaltovog dioksida, s povećanim naponom i mobilnosti litijevih iona.
1985. – Akira Yoshino zamjenjuje metalni litij na anodi s litijem interkaliranim u posebno pripremljen naftni koks, a kasnije i grafit.
1991. – Sony izlazi na tržište s prvom komercijalnom litij-ionskom baterijom, s Yoshinovim anodom i Goodenoughovim kobaltovim dioksidom na katodi.
2004. – Yet-Ming Chiang dalje poboljšava katodu primjenom nanočestica željezovog fosfata. U usporedbi s kobaltovim dioksidom, Chiangove baterije imaju nešto manji napon i kapacitet, ali mogu izdržati 4-5 puta više ciklusa punjenja i pražnjenja.
2019. – John Goodenough, Stanley Whittingham i Akira Yoshino dobivaju Nobelovu nagradu za razvoj litijionskih baterija.
12. https://www.cleanenergywire.org/news/renewables-cover-about-100-german-power-use-first-time-ever