medicina i biologija
Tumori i živčani sustav. Sve više dokaza da stres potiče njihov nastanak i napredovanje. Kojim mehanizmima
 Tamara Čačev / 21. svibnja 2021. / Perspektive / čita se 14 minuta
Tamara Čačev / 21. svibnja 2021. / Perspektive / čita se 14 minuta

 Tamara Čačev / 21. svibnja 2021. / Perspektive / čita se 14 minuta
Tamara Čačev / 21. svibnja 2021. / Perspektive / čita se 14 minuta

Kako se sistemski stres pretvara u tumorski rast, pita Tamara Čačev. Stres i njemu pridruženi fiziološki odgovor prevodi se u signale na molekularnoj razini pojedinih stanica i utječe na tumorske stanice. Sistemski stres potiče tumorigenezu karcinoma dojke, jajnika, gušterače i prostate putem aktivnosti simpatičkog živčanog sustava.
Sigurno ste nebrojeno puta čuli ili nekome rekli: “nemoj se nervirati, navući ćeš si neku boleštinu ili rak“, a gotovo svakodnevno se u medijima pojavljuje neki prilog o stresu kao jednom od bitnih čimbenika nastanka nekih od najčešćih bolesti današnjice. Iako se toj temi načelno puno govori, sve do recentnijih znanstvenih studija neuralna komponenta nastanka i napredovanja tumora nije bila niti približno istraživana te ne postoji jednostavno objašnjiva i univerzalno primjenjiva uzročno-posljedična veza između neuralne regulacije i nastanka i napredovanja tumora.
Poznata je uloga živčanog sustava u rastu i razvoju organizma, te održavanju ravnoteže fizioloških procesa. Poznati su neuralni regulatorni mehanizmi, svojevrsne signalne mreže, koje sudjeluju u ‘normalnim’ fiziološkim procesima u organizmu pa stoga nije nelogično razmišljanje je li moguće da poremećaji ovih signalnih puteva mogu imati i patofiziološku ulogu primjerice tijekom nastanka, rasta i napredovanja tumora.
Naše je tijelo premreženo živcima koji dopiru do najsitnijih struktura u našem organizmu te sudjeluju u svim životno važnim procesima kojih nismo niti svjesni, niti možemo kontrolirati svojom voljom, kao i našim voljnim i misaonim procesima (slika 1). Trenutno je u Galeriji Klovićevi dvori u tijeku izložba Bodies 2.0 na kojoj je jako plastično i inovativno prikazano kako izgleda ljudsko tijelo iznutra, što je odlična prilika da dođemo do susreta sa svojim unutarnjim i to na onoj najdoslovnijoj razini.

U istraživanjima nastanka i napredovanja tumora najprije su otkrivani pojedinačni geni, onkogeni i tumor supresorski geni, i to najprije oni čija se uloga mogla jasno i nedvosmisleno detektirati i potvrditi. Napredak tehnologije u molekularnoj biologiji omogućio je da se količina znanja iz pionirskih pothvata iz druge polovice prošlog stoljeća, kada se jedan gen „otkrivao“ i proučavao i po koju dekadu, danas kolektivno generira nerijetko tijekom svega jedne godine. Stoga su na red za istraživanje, osim očitih proskribiranih dežurnih krivaca koji sudjeluju u nastanku i napredovanju niza različitih tumora poput gena K-Ras i p53 ili gena za popravak grešaka u zapisu DNA, došli i oni geni za koje nismo mogli ni pretpostavljati da bi mogli imati ulogu u tumorigenezi.
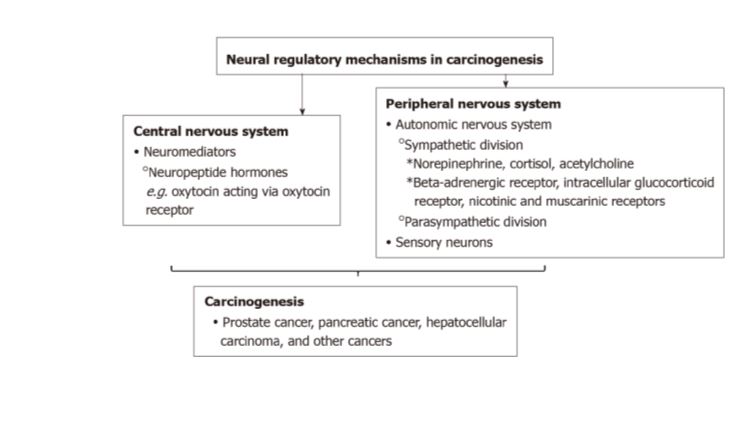
Postoji sve više dokaza kako su procesi, odnosno molekularni signali putem kojih živčani sustav u normalnim uvjetima sudjeluje u organogenezi te održavanju dinamičke ravnoteže organizma (homeostaze), poremećeni i tijekom najranijih događaja u pretvorbi normalnih stanica u tumorske kao i u njihovoj daljnjoj progresiji. Uistinu, takva uloga živčanog sustava pokazana je već i u nekim tumorima poput tumora želuca, gušterače, prostate te nekih malignih promjena kože.
Nekad se naime smatralo kako u solidnim tumorima ne postoji mreža živčanih vlakana, kasnije se ta komponenta zanemarivala, no danas znamo da tijekom nastanka tumora dolazi do neurogeneze živčanih vlakana koja se infiltriraju u tumor. Dapače, u tumorima dojke i prostate veća premreženost tumora živčanim vlaknima povezana je s agresivnijim tumorima i lošom prognozom.
Osim promjena u samim tumorskim stanicama koje vode u progresiju tumora bitne su i promjene u njegovom mikrookolišu, odnosno stanicama koje nisu tumorske ali mogu u odnosu na njih imati potpornu ili inhibitornu ulogu. Mikrookoliš tumora je možda jednako važan čimbenik u tumorigenezi jer o njemu ovisi hoće li okolina biti povoljna ili nepovoljna za rast tumorskih stanica odnosno metastaza. Osim očite uloge u omogućavanju dostupnosti vitalnih hranjivih tvari i kisika za tumor, u mikrookolini tumora djeluje i niz signalnih puteva koji su regulirani lokalno ali i centralno na razini čitavog organizma. Ovi procesi su dvosmjerni jer i tumor djeluje na stanice svog mikrookoliša nastojeći ih pogurnuti u za sebe povoljnijem smjeru.
Stanice unutar zdravog tkiva su ograničene u svom rastu te je arhitektura tkiva kao i položaj pojedinih stanica strogo definiran. Danas znamo da u raznim tkivima/organima postoje niše tzv. matičnih stanica koje su izvor stanica iz kojih se tkivo/organ obnavlja. Ono što također znamo jest da je unutar tih niša prisutna i komponenta živčanog sustava te da živci aktivno sudjeluju u oblikovanju i razvoju ovih niša. Da bi se stanice u nišama krenule kontrolirano i planski dijeliti potreban je vanjski signal. Nedavno je otkriveno da završeci živaca u blizini matičnih stanica mogu davati stimulativne signale koji potiču rast matičnih stanica. Stoga se i pojavila ideja da bi živčani sustav, odnosno neuralna regulacija, mogli biti jedan od bitnih ranih čimbenika u procesu maligne transformacije.
Obrazac održavanja tkivne homeostaze (normalnog fiziološkog stanja, dinamičke uravnoteženosti procesa u tkivima) u ovisnosti o signalima koji dolaze sa živčanih završetaka u niše matičnih stanica pokazan je u nizu tkiva. Primjerice u probavnom sustavu kolinergični signali koji se prenose putem muskarinskog receptora Chrm3 reguliraju procese u niši enteritičkih matičnih stanica. Koliko je važna ova regulacija pokazuju eksperimenti denervacije (prekida živčanih vlakana) kojima dolazi do atrofije želuca. Dakle, ako nema kontunuiranog poticaja od živčanog sustava, tkivo želuca atrofira. Slično je pokazano i u kirurškoj denervaciji prostate, organa koji je gusto promrežen živcima, što također uzrokuje atrofiju, dok primjerice djelovanjem adrenergičkih agonista dolazi do suprotnog procesa odnosno hipertrofije prostate. Ovakav princip regulacije niša matičnih stanica pokazan je i u tkivima crijeva i jetre ali i kože.
Već je dugo primijećen fenomen tumorskih stanica koje urastaju u živce ili rastu duž njih te da takve pojave koreliraju s većom agresivnosti tumora i nepovoljnijom prognozom za oboljelog. Takva su opažanja potvrđena u tumorima glave i vrata, adenokarcinomima prostate te gušterače
Koja je uloga živčanog sustava u regulaciji neoplastičnih niša, jezgri iz kojih nastaju prve maligno promijenjene stanice? Je li moguće da i ovdje živčani sustav ima nekakvu ulogu? Već je dugo vremena primijećen fenomen tumorskih stanica koje urastaju u živce ili rastu duž njih te da takve pojave koreliraju s većom agresivnosti tumora i nepovoljnijom prognozom za oboljelog. Takva su opažanja potvrđena u tumorima glave i vrata, adenokarcinomima prostate te gušterače. Pretpostavljalo se kao tumorske stanice koriste živce kao put za metastaziranje u tzv. perineuralnom širenju bolesti. No ideja da bi živčane stanice i tumorske stanice mogle međusobno komunicirati, odnosno ideja o neuralnoj regulaciji tumorigeneze već u ranim fazama nastanka i napredovanja tumora je nova.
Da je međusobna komunikacija između tumorskih stanica i živaca pristuna pokazuje i činjenica da tumori šalju signale kojima aktivno privlače urastanje živaca u tumorski mikrookoliš. Ovaj je fenomen prvi puta pokazan na tumorima prostate kako u samih oboljelih tako i u različitim modelima kulture stanica u kojima su zajedno uzgajane tumorske stanice prostate te jedna vrsta živčanih stanica prilikom čega je dokazano da tumorske stanice luče čimbenike koji potiču rast živaca odnosno aksonogenezu. Jedan od prvih takvih okarakteriziranih čimbenika bio je neuralni faktor rasta (NGF). Radi se o jednom od čimbenika iz obitelji neurotropina, proteina koji stimuliraju rast, opstanak i plastičnost centralnog i perifernog živčanog sustava. Interesantno je kako se on daleko najviše izučavao u kontekstu istraživanja u neuroznanosti iako je otkriven u istraživanjima tumora kao produkt lučenja tumorskih stanica sarkoma gdje je poticao rast živčanih stanica. Danas je kauzalna veza između inervacije tumora prostate, lučenja NGF te nepovoljne prognoze direktno pokazana na in vivo mišjem modelu te se stabilizirala ideja o inervacijom-reguliranoj progresiji tumora prostate. Prostata je i u normalnim fiziološkim uvjetima inervirana vlaknima autonomnog živčanog sustava te je za normalni razvoj i održavanje normalnih uvjeta bitna i uloga autonomnih neurotransmitera. No, nažalost, oni imaju ulogu i u progresiji tumora prostate. Dokazano je primjerice kako adrenergični signali povećavaju migraciju tumorskih stanica prostate (a ta sposobnost je ključna u procesu metastaziranja) i u in vitro i u in vivo uvjetima dok blokada receptora za ove signale ograničava sposobnost tumora da metastazira. U in vivo modelima je također pokazano kako je simpatička inervacija putem ovih receptora bitna i za rane faze nastanka tumora prostate, a kad jednom nastane tumor, on je izrazito premrežen živcima parasimpatičkog (kolinergičkog) sustava te signalizacija putem muskarinskih receptora Chrm1 potiče daljnje metastaziranje ovog tumora. Dakle, autonomni živčani sustav sudjeluje kako u najranijim događajima nastanka tumora prostate tako i u njegovom metastaziranju te se ovi utjecaji aktivno potiču od strane tumorskih stanica lučenjem specifičnih čimbenika poput NGF koji stimuliraju urastanje živaca u tumor.
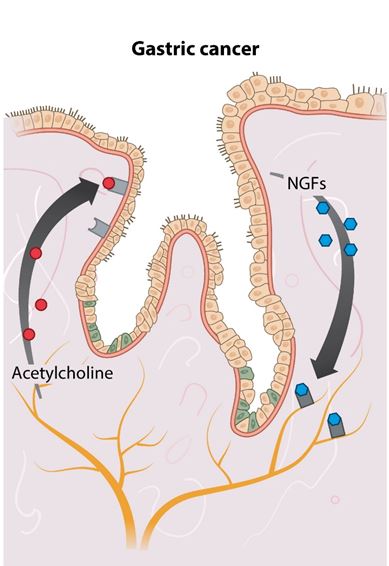
Interakcija tumorskih stanica sa živčanim sustavom te uloga neuralne regulacije u tumorigenezi pokazana je i u tumorima želuca. U ovim tumorima neoplastične stanice luče neurotropine koji, kako im samo ime i govori, potiču urastanje živaca u tumorski mikrookoliš. S druge pak strane živčane stanice putem neurotransmitera potiču progresiju tumora. Obrazac djelovanja je sličan – kolinergička inervacija stimulira rast tumorskih stanica želuca putem acetilkolina koji aktivira jedan od ključnih tumorskih signalnih puteva (Wnt) u tumorskim stanicama. S druge pak strane, denervacija suprimira tumorigenezu. Radi se o primjeru pozitivne povratne sprege između kolinergičkih želučanih živaca i tumorskih stanica želuca (koja je n.b. rijetka pojava u regulaciji normalnih procesa u organizmu jer vodi u amplifikaciju signala koju je kasnije teško obuzdati, primjerice kod zgrušavanja krvi). U ovoj petlji pozitivne povratne sprege acetilkolin, kojeg prvotno otpuštaju stanice koje su već prisutne u mikookolini tumora a kasnije živci koji su urasli u tumor, stumulira proizvodnju NGF. NGF pak stimulira daljnje uraštanje živaca u tumor i sve bolju tumorsku inervaciju koja pak vodi do još većeg otpuštanja acetilkolina. Acetilkolin pak stimulira proliferaciju tumorskih stanica te rast tumora. (Slika 2). U ove su procese uključene obje grane periferenog živčanog sustava i parasimpatička (kolinergička) i simpatička (adrenergička) i to u analognim petljama pozitivne povratne sprege između tumorskih i živčanih stanica. Ove dvije grane autonomnog živčanog sustava djeluju neovisno i po antagonističkom principu na iste procese te ih tako u normalnim uvjetima drže pod kontrolom, no u uvjetima stresa dolazi do poremećaja u ovoj raznoteži što dugoročno vodi u nastanak bolesti.
Kako se sistemski stres pretvara u tumorski rast? Ili kako dolazimo do one laičke konstatacije s početka ovog teksta. Stres i njemu pridruženi fiziološki odgovor prevodi se u signale na molekularnoj razini pojedinih stanica i pokazano je da utječe na tumorske stanice. U znanstvenoj je literaturi već opisano nekoliko primjera direktnog sistemskog utjecaja stresa putem podizanja razine hormona/neurotransmitera u cirkulaciji koji pak zatim utiču na progresiju tumora. U eksperimentalnim je uvjetima pokazano kako simpato-adrenomedularni (tzv fight or flight) i hipotalamus-hipofiza- adrenokortikalni putevi imaju utjecaj u tumorigenezi. Primjerice fight or flight signalizacija u svega nekoliko sekundi izaziva sistemske promjene u cijelom organizmu putem sekrecije kateholamina (epinefrin (adrenalin) i norepinefrin (noradrenalin)) kao reakciju na stres. Signalizacija putem hipotalamusa i hipofize ide malo sporije jer se ovdje radi o hormonima (gluko- i mineralokortikoidima) koji popratno pojačavaju odgovore koje je izazvao fight or flight signalni put. Istraživanjem ovih tipova odgovora na stres pokazano je kako sistemski stres potiče tumorigenezu karcinoma dojke, jajnika, gušterače i prostate i to putem aktivnosti simpatičkog živčanog sustava.
Iz pojedinačnih studija na raznim tumorskim modelima naziru se neke zajedničke mehanističke crte i signalni putevi koji bi mogli dominirati procesima neuralne regulacije tumora. Primejrice signalni put cAMP-PKA je potvrđen u nekoliko modela kao onaj putem kojeg se signal sa stresom podraženog beta-adrenergičkog receptora prenosi dalje u stanicu. Nasuprot tome, u tumorima dojke stresom inducirani beta-adrenergički receptori okidaju metaboličke promjene u stanici. Također je tek potrebno istražiti u kojoj je mjeri bitan lokalni utjecaj norepinefrina koji se luči u mikorookolini tumora u odnosu na sistemski utjecaj kateholamina koji se u organizmu luče kao odgovor na kronični stres.
Kako bi stvari bile još kompliciranije dvije grane autonomnog živčanog sustava (parasimpatička i simpatička) čini se imaju različiti učinak na progresiju različitih tipova tumora. Primjerice dok je povećana aktivnost simpatičke grane prisutna u ranim fazama rasta tumora prostate, ta ista grana je također odgovorna za kasnije događaje kao što je nastanak metastaza u tumorima dojke. S druge pak strane u melanomima je eksperimentalni prekid signalizacije putem simpatičke grane izazivao odgođeni razvoj tumora te dulje preživljenje. U istom eksperimentalnom modelu dokidanje parasimpatičke aktivnosti (vagotomija) nije imala nikakvog učinka na prije spomenute parametre. No, suprotno ovim nalazima u tumorima želuca upravo je dokidanje aktivnosti parasimpatičke grane (vagotomija) imalo supresivni učinak na tumorigenezu (slika 3). Naravno, niti jedan od ovih sustava ne djeluje izolirano pa su tako i istraživanja međusobne komunikacije između živčanog i imunosnog sustava u kontekstu tumora također jedno od zanimljivih područja koje je tek načeto istraživanjima, kao i ono o utjecaju kroničnog stresa na kroničnu upalu koja je također jedna od bitnih čimbenika u nastanku i napredovanju tumora.
Ipak, načelno, na temelju dosadašnjih spoznaja, simpatička grana je jače aktivna u uvjetima stresa odnosno tzv fight or flight odgovora. Stoga ne čudi kako je u in vivo modelima pokazano kako povišena simpatička aktivnost vodi u progresiju tumora. S druge pak strane, nedavno je izašla i retrospektivna studija u žena oboljelih od karcinoma dojke koje su zbog drugih razloga uzimale terapiju beta-blokatorima gdje se pokazalo kako je smrtnost u skupini žena na ovoj terapiji bila manja u odnosu na one koje nisu primale tu terapiju. Racionala za ovakav učinak beta-blokatora je da oni blokiraju učinak simpatičkog živčanog sustava koji u odsutnosti ove terapije djeluje poticajno na progresiju tumora dojke upravo putem signala s beta-adrenergičkih receptora.
Epidemiološke studije pokazale su povezanost između psiho-socijalnih uvjeta oboljelih i progresije nekih tipova tumora i njihovog metastaziranja.
Zaključno možemo reći kako je utjecaj neuralne regulacije tumorigeneze s jedne strane lokalni i pod utjecajem neposredne mikorookoline tumora a s druge strane i sistemski (na razini čitavog organizma) putem dvije spomenute regulatorne osi u kojoj jednu od značajnijih uloga ima hipotalamus. S druge pak strane, sami tumori bi mogli povratno utjecati na funkciju hipotalamusa kod oboljelih od nekih tipova tumora. Tako je primjerice pokazano kako tumori mogu utjecati na spavanje ili na metabolizam glukoze u jetri kroz utjecaj na cirkadijanu i metaboličku regulaciju putem hitpotalamusa. Epidemiološke studije pokazale su povezanost između psiho-socijalnih uvjeta oboljelih i progresije nekih tipova tumora i njihovog metastaziranja. Također postoje neki preliminarni pokazatelji da se tijekom različitih psiho-socijalnih okolnosti molekularni profili tumora mogu izmijeniti te će se zasigurno u budućnosti razvijati i nova područja istraživanja poput psiho-onkologije ili socijalne genomike.
Ispreplitanje do sada ne previše povezanih istraživanja u neuroznanosti s istraživanjima tumorigeneze zahtijevat će obostrano upoznavanje područja, tehnika i metoda istraživanja ali i samih znanstvenika koje će rezultirati novim hibridnim interdisciplinarnim istraživanjima. Kompleksni međuodnosi između stresa, inervacije tumora, nastanka novih krvnih žila u tumorima te imunosnog sustava tek se trebaju razotkriti a ta bi istraživanja mogla ukazati na nove mete za potencijalnu antitumorsku terapiju.
Literatura: