BIOLOGIJA
Epistaza. Nasljednost koja nedostaje skrivena u složenoj interakciji gena
 Tamara Čačev / 7. rujna 2023. / Perspektive / čita se 10 minuta
Tamara Čačev / 7. rujna 2023. / Perspektive / čita se 10 minuta
 Tamara Čačev / 7. rujna 2023. / Perspektive / čita se 10 minuta
Tamara Čačev / 7. rujna 2023. / Perspektive / čita se 10 minuta

Projekt humanog genoma nosio je nadu da ćemo moći pronaći genetske uzročnike svih mogućih svojstava, od nasljednih bolesti do inteligencije, no pred kraj projekta postalo je jasno kako su ta očekivanja bila preoptimistična. U svojem tekstu o epistazi, Tamara Čačev objašnjava izazove koje pred znanstvenike stavljaju kompleksni genetski sustavi koji ovise o međusobnoj interakciji mnogih gena, u kojima je teško povezati genotip s fenotipom.
U znanosti, većinom kompleksne fenomene u prirodi nastojimo raščlaniti na niz jednostavnijih elemenata kako bismo si olakšali proces istraživanja. To je apsolutno neophodno jer bez toga nikada ništa ne bismo spoznali o svijetu koji nas okružuje. No sasvim je jasno da se sa svakom simplifikacijom gubi dio informacije, a ponekad je taj dio uistinu bitan. Kada govorimo o suvremenoj genetici tada je jedan od takvih primjera i fenomen epistaze, fenomen kojeg bismo mogli nazvati i anglosaksonskim idiomom „slona u sobi“, problema za koji se svi prave kao da ne postoji i prigodno ga izbjegavaju.
Pod ovim pojmom podrazumijevamo svojevrsnu nelinearnost koja je prisutna u biološkim sustavima a do koje dolazi uslijed specifičnosti samih staničnih procesa kojima se informacija zapisana u molekuli DNA (genotip) manifestira u svojstvima nekog organizma (fenotip). Ovi su pak procesi pod selektivnim evolucijskim pritiskom koji povezuje fenotip i sposobnost opstanka, pa tako uslijed selekcije neće sve što se iz genotipa manifestira u fenotipu uistinu i preživjeti test uvjeta okoliša i evolucije. Na taj će se način dio mogućih manifestacija fenotipa naprosto izgubiti iz populacije jer ne prolazi test evolucije. Istraživati ovako kompleksne sustave veliki je zalogaj jer treba povezati genotip s fenotipom i dalje s evolucijskim fitnessom za niz genskih varijanti koje su u međusobno u različitim mrežama interakcija.
Na razini gena se u fenomenu epistaze radi o interakciji između više gena gdje učinak jedne od varijanti nekog gena (alel) ovisi o varijanti (varijantama) nekog drugog gena ili čak više njih. Već je iz ove definicije vidljivo da ako suzimo fokus samo na ispitivanje jednog gena, takvu vrstu interakcije nećemo opaziti a može biti bitna za adaptaciju i specijaciju. Fenomenom epistaze mogao bi se objasniti jedan drugi koji ću u nedostatku boljeg naziva prevesti kao „nasljednost koja nedostaje“ (od engl.„missing heritability“) koji je prisutan u etiologiji gotovo svih poligenskih svojstava. Ovaj termin, skovan 2008. godine, odnosi se na činjenicu da se samo dio nasljednosti nekog poligenskog svojstva, primjerice sklonosti obolijevanja od neke kronične nezarazne bolesti, može opisati varijacijama u nekom od gena povezanih s tom bolešću. Naime, pod ovim nazivom krije se ideja da nasljedna predispozicija za neku bolest možda u većoj mjeri ovisi o udruženom učinku više gena koji čine svojevrsni background nego o poznatim „etabliranim“ genima koji su prvotno s njome povezani. Prema toj pretpostavci „etabliranim genima“ se potencijalno daje možda i preveliki značaj u odnosu na njihov stvarni doprinos, pri čemu se misli posebice na one situacije gdje kauzativni gen objašnjava tek mali dio nasljednosti.

Negdje do pred kraj Projekta humanog genoma (The Human Genome Project) postalo je jasno da se na njegove rezultate gledalo preoptimistično u nadi da će nam dati odgovore na sva otvorena pitanja vezano uz našu genetiku te da će se konačno moći povezati nasljedne osobine i bolesti s točno određenim genima i njihovim varijantama. No, iako je ovo područje dobilo vjetar u leđa te su uistinu i otkriveni mnogi geni koji se nalaze u podlozi niza monogenskih bolesti kao i onih s nasljednom komponentom u kojoj sudjeluje manji broj kauzativnih gena, priličan broj studija u kojima se istraživao gen kandidat za određenu bolest ili studije varijacija genskog zapisa u svega jednoj bazi (tzv. SNP) nisu urodile plodom. Ništa bolje rezultate nisu dale ni opsežne analize čitavog genoma (tzv. GWAS studije) kojima se istovremeno obuhvatio čitav genom i gotovo svi geni koji se u njemu nalaze. Iako se puno napora uložilo posebice u analizu kompleksnih svojstava poput inteligencije ili nekih mentalnih bolesti, prvotno otkriveni geni kandidati većinom nisu potvrđeni u neovisnim studijama. Ipak, kada se vratimo klasičnoj genetici, uloga nasljedne komponente u određivanju inteligencije je nedvojbeno potvrđena, no kauzativnih gena nigdje na vidiku unatoč znatnim naporima koji su uloženi u ta istraživanja.
Jasno je da svako složeno svojstvo rijetko kad biva kodirano samo jednim genom, no nisu otkriveni niti geni koji bi udruženi u kumulativni učinak u značajnijoj mjeri mogli objasniti nasljednost inteligencije. Razlozi neuspjeha leže u samom dizajnu studija kao i metodologiji i načinu kako se određuje IQ. Nije neosnovano razmišljati ni kako se zapravo radi o kodiranju putem velikog broja gena od kojih svaki pomalo doprinosi ovom svojstvu a svaki pojedinačni doprinos je toliko minoran da se stoga i ne može detektirati. Zatim je u nekim studijama predloženo da je inteligencija zapravo epigenetski regulirano svojstvo, dakle ništa nije vidljivo na razini samog zapisa u DNA te je stoga nevidljivo prijašnjim načinom istraživanja.
Kako bilo, fenomen nasljednosti koja nedostaje tj. nasljednosti koju vidimo ali ne možemo prstom uprijeti u njezin uzrok, još uvijek ostaje nerazriješen. Do ovog se problema došlo zbog toga što se najčešće u istraživanju nasljedne komponente poligenskih bolesti ispituje učinak jedne po jedne varijante svakog od gena na neko svojstvo. Učinak svih varijanti se zatim sumira kako bi se dobila ukupna genetska varijacija pri čemu ovaj aditivni model nasljeđivanja uzima kao pretpostavku da je pojedinačni učinak svake varijante neovisan o doprinosu svih ostalih. Ideja epistaze uvodi razmišljanje da je učinak jedne varijante gena na neko kompleksno svojstvo ovisan o genotipu tj. varijanti nekog drugog gena te da oni imaju udruženi učinak ali samo u određenim kombinacijama, i to ne u svim. Primjerice samo kombinacija gena A u verziji X udružena s genom B u verziji Y ima učinak na neko svojstvo ili na sklonost obolijevanja od neke bolesti, dok neke druge kombinacije to nemaju.
Kada se u školi uče Mendelovi zakoni nasljeđivanja uvijek je primjer križanje graška. Iz svega prije navedenog jasno je kako je Mendel imao pravu sreću u odabiru modela i svojstava koja će promatrati. Jer primjerice da je svoju pažnju usmjerio na genetiku boje očiju danas vjerojatno ne bismo ovdje o njemu pisali. U njegovom modelu svako je svojstvo bilo neovisno o drugome i u potpunosti kontrolirano jednim genom. Takvi primjeri su zapravo rijetkost, većina svojstava je zapravo pod kontrolom više gena. Ako uzmemo primjer da je neko svojstvo određeno sa samo 2 gena te da svaki od njih ima barem 2 verzije (a može ih imati i puno više) jasno je koliko je mogućih kombinacija ovih utjecaja. U slučaju svojstva boje očiju do danas je opisano barem osam gena svaki sa svojim varijantama. Ako izračunamo koliko bi tu bilo mogućih kombinacija jasno je da bi za svoje analize Mendel trebao puno veće grupe kako bi uopće došao do nekog statistički značajnog rezultata. Istraživanje mreže interakcija gena koje utječu na neko svojstvo je zahtjevno budući da je glavna prepreka sveobuhvatnim analizama ukupni broj mogućih interakcija koje bi trebalo ispitati a čiji broj raste s kvadratom broja gena koji se analiziraju. Tako bi npr. za analizu interakcija u genomu kvasca S. cerevisiae trebalo ispitati više od 18 milijuna različitih interakcija. Stoga se velike nade polažu u nove modele koji uključuju i primjenu umjetne inteligencije.
Udruženi učinak gena može se pojaviti bez da njihovi produkti ikada stupe u interakciju. Klasični primjer takvog učinka je „paljenje i gašenje“ mnogih gena koji sudjeluju u organogenezi a koji djeluju sekvencijalno u vremenu te se učinak svakog gena nadograđuje na učinak prethodnog što u konačnici dovodi do nastanka specifičnog organiziranog sustava stanica kakav je neki organ.

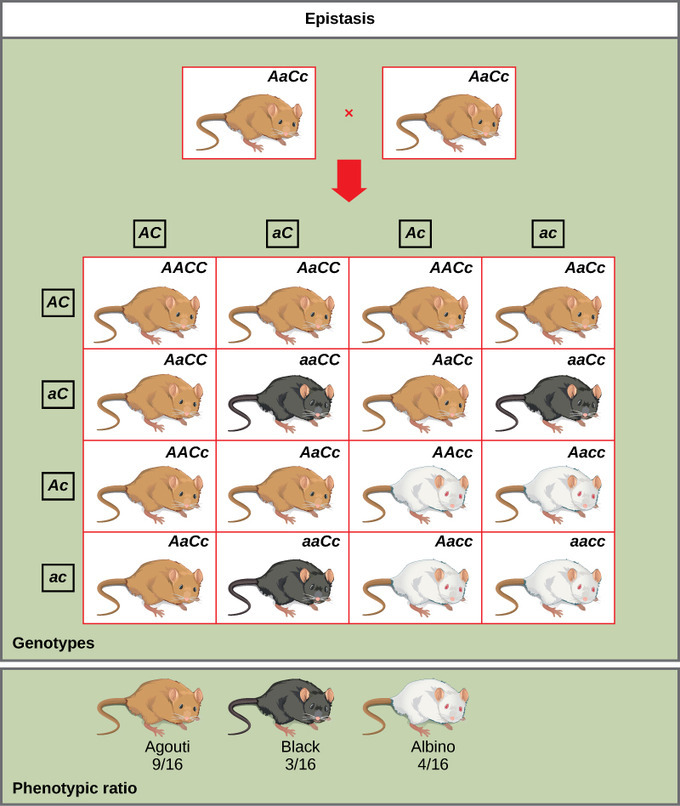
Iz svega navedenog proizlazi da u fenomenu epistaze jedan gen maskira ili interferira s ekspresijom drugog. Ukoliko vam je sve ovo prije bilo previše apstraktno navest ću još jedan od primjera epistaze koji se odnosi na genetiku boje krzna miševa (vidi sliku dolje). Verzija gena (alel A) koja kodira za najučestaliju boju krzna (tzv. agouti, riječ je zapravo o kombinaciji dvije vrste pigmentacije koja daje dojam smeđesivog, genotipovi Aa, AA) je dominantna u odnosu na jednobojne crne miševe (alel a, genotip aa). Dodatno, proizvodnja pigmenta ovisi o drugom genu C. Verzija ovog gena pri kojoj miševi ne mogu proizvoditi pigment (alel c) logično je recesivna u odnosu na verziju u kojoj miševi imaju alel C koji omogućava mišu da proizvodi pigment. Zašto je to logično? Jer će se situacija u kojoj dolazi do proizvodnje pigmenta odraziti dominantno na izgled miša u odnosu na situaciju kada se pigment ne može proizvesti. Produkcija pigmenta je dominantna u odnosu na njegovu nemogućnost proizvodnje jer to je ono što vidimo kao boju krzna.
Vratimo se interakciji ovog gena za proizvodnju pigmenta s genom za boju koja će se proizvesti. Kada miš zbog alela c ne može proizvoditi pigment tada je on albino bez obzira koja boja mu je zapisana na genskom lokusu za boju. Stoga genotipovi (kombinacije tih dvaju gena) AAcc, Aacc, and aacc sve daju albino miševe u fenotipu. Kažemo kako je gen C u epistatskom odnosu s genom A budući da „maskira“ njegov utjecaj. Križanjem miševa heterozigotnog statusa za oba gena (AaCc x AaCc) generira potomstvo u omjeru 9 agouti:3 jednobojni:4 albino (slika 1). Primijetimo da je ovo školski primjer gdje je model životinja s puno potomaka u jednom okotu pa se taj omjer donekle i može utvrditi eksperimentalno, no ovaj primjer je zapravo neiskoristiv za bilo koje svojstvo čovjeka.
Iako epistazu najčešće razmatramo u kontekstu kompleksnih svojstava i viših organizama, ovaj se fenomen može javiti primjerice i kod virusa, jer i oni imaju svakako više od 2 gena koji mogu na nelinearan način biti u nekom međuovisnom odnosu. Tako virus HIV-a može steći mutacije koje ga čine otpornim na terapiju no one ne djeluju neovisno već ovise o genetičkom backgroundu svakog soja odnosno o tome jesu li u genomu virusa prisutne i neke druge mutacije.
Ponekad rezultati epistaze mogu biti i neočekivani. Objasnit ću to na primjeru visine stabljike neke zeljaste biljke za koju postoje dvije različite mutacije koje utječu na to svojstvo. Mutacija X daje izduženu, dok mutacija Y rezultira kraćom stabljikom u odnosu na prosječnu visinu biljke. Ako bi se u nekoj jedinki istovremeno našle verzije gena za izduženu i kraću stabljiku mogli bismo pretpostaviti kako će se one međusobno „poništiti“ i dati stabljiku prosječne visine. No, umjesto toga dobivamo biljke ekstremno kratke stabljike. Takav nalaz ukazuje na nelinearni odnos mutacija A i B te je daje neočekivani fenotip koji je također karakteristika epistaze.
U novije vrijeme javila se i ideja o globalnoj epistazi odnosno mogućnosti da varijanta jednog gena nema učinak samo na neku od varijanti nekog drugog gena već da postoje svojevrsni „geni za epistazu“ koji djeluju globalno na čitav genom kao epistatski modifikatori niza drugih gena. Vjerojatno ste iz ovih primjera mogli steći dojam o kompleksnim sustavima kojima se bavi molekularna genetika te zašto je epistaza fenomen kojeg bi mnogi najradije zaobišli u svojim istraživanjima. No, na početku ere mogućeg opsežnijeg interveniranja u genome organizama fenomen epistaze mogao bi se manifestirati u obliku neželjenih nepredviđenih posljedica takvih intervencija. Stoga se epistaza ne može ignorirati poput proverbijalnog anglosaksonskog slona u sobi s početka ove priče koliko god mi to željeli, budući da bez njenog razrješavanja neće biti niti ozbiljnijih pomaka u rasvjetljavanju kompleksnih poligenskih bolesti koje zapravo čine većinu onog što nam skraćuje životni vijek kao niti opsežnijih intervencija u genom.
Singhal P, Verma SS, Ritchie MD (2023) Gene Interactions in Human Disease Studies-Evidence Is Mounting. Annu Rev Biomed Data Sci;6:377-395
Cordell, H (2002) Epistasis: What it means, what it doesn’t mean, and statistical methods to detect it in humans. Human Molecular Genetics 11, 2463–2468
Biswas A, Haldane A, Arnold E, Levy RM (2019) Epistasis and entrenchment of drug resistance in HIV-1 subtype B eLife 8:e50524