medicina
Nova otkrića o Parkinsonu i Alzheimeru: osovina crijeva-mozak. Plus mikroorganizmi koji žive u našem probavnom sustavu
 Tamara Čačev / 22. lipnja 2019. / Članci / čita se 9 minuta
Tamara Čačev / 22. lipnja 2019. / Članci / čita se 9 minuta

 Tamara Čačev / 22. lipnja 2019. / Članci / čita se 9 minuta
Tamara Čačev / 22. lipnja 2019. / Članci / čita se 9 minuta

Povezanost mozga i probavnog sustava opisana je u nizu fizioloških i patofizioloških stanja. Sada se u ovu paradigmu pokušava integrirati i mikroorganizme koji nastanjuju naš probavni sustav. Njih tamo ima toliko da nadmašuju broj naših stanica, a prema nekim izračunima kada bismo ih se riješili bili bismo i par kilograma lakši.
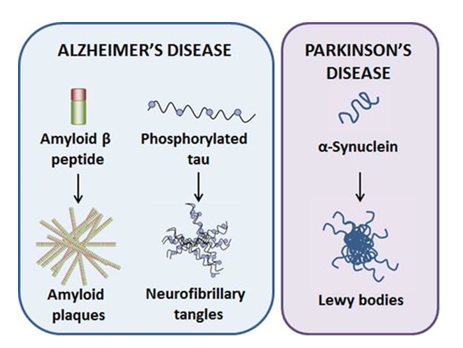
U državama u kojima je veliki udio populacije starije životne dobi, pa tako i u Hrvatskoj, broj oboljelih od Alzheimerove i Parkinsonove bolesti, dvaju najčešćih neurodegenerativnih oboljenja, u kontinuiranom je porastu. Iako sporadični zapisi o ovim bolestima potječu još iz doba drevnog Egipta, obje su imenovane po liječnicima koji su ih prvi puta sustavnije opisali i uveli u medicinsku literaturu. Tako je engleski kirurg Dr. James Parkinson 1817. godine u šetnjama parkom uočio starije osobe karakterističnog sitnog hoda s nekontroliranim podrhtavanjem ruku, dok je 1907. godine Dr. Alois Alzheimer u mozgu žene koja je umrla od neobične mentalne bolesti karakterizirane gubitkom pamćenja, problemima s govorom te nepredvidivog ponašanja, otkrio specifične strukture koje danas nazivamo amiloidnim plakovima odnosno nakupinama proteina tau.
No, iako su ove bolesti već dugo prepoznate a u posljednjih pedesetak godina i vrlo intenzivno istraživane, njihov uzrok je još nepoznat. Ono što se zna je da u mozgu oboljelih dolazi do nakupljanja specifičnih proteina (kod Parkinsona je to alfa-sinuklein, za razliku od beta-amiloida u Alzheimerovoj bolesti, dok je hiperfosforilacija i agregacija proteina tau povezana s obje) koji onda stvaraju plakove i inkluzije čime oštećuju neurone, uzrokuju neuroinflamaciju te u konačnici izazivaju i njihovo odumiranje. Tijekom vremena dolazi do progresivnog neurološkog propadanja koje se manifesira karakterističnim simptomima ovih bolesti.
Kada želite igrati na sigurno, onda kažete kako je neka nezarazna bolest rezultat genetskih čimbenika, načina života te faktora okoliša, i naravno, niste rekli ništa krivo. Tako je i za ove bolesti u vrlo malom postotku (5-10%) oboljelih utvrđeno postojanje nasljedne genetičke podloge, disfunkcije najčešće povezane s mutacijom nekog od gena koji su uključeni u signalne puteve s prethodno spomenutim ključnim proteinima. No, većina oboljelih nema jasno definiranu genetičku promjenu (eventualno se govori o klasteringu danas još nedefiniranih gena koji bi možda mogli udruženo davati veću predispoziciju za obolijevanje) koja bi se mogla povezati s pojavom ovih bolesti. Dakle, uzroci za nastanak ovih bolesti se vjerojatno nalaze skriveni u načinu života i čimbenicima okoliša. Od okolišnih faktora najčešći krivci su pesticidi i teški metali, dok je segment životnog stila najfluidniji koncept, izuzmemo li pušenje i konzumaciju alkohola, budući da je teško vjerodostojno pratiti npr. čime se netko hranio kroz proteklih tridesetak godina svojega života, osim u ekstremnim slučajevima osoba koje su radile u sustavima s nutricionističkim praćenjem poput profesionalnih vojnika ili osoba u zdravstvenom sustavu koje su se hranile u menzama s definiranim nutricionističkim parametrima.
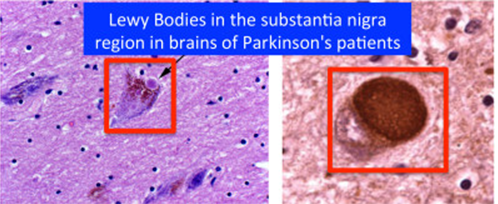
U znanstvenoj literaturi stoga postoji niz hipoteza o tome što bi moglo izazvati inicijalno nakupljanje aberantnog alfa-sinukleina, beta-amiloida ili proteina tau i time okinuti domino reakciju koja, kako se danas pretpostavlja, može potrajati i više desetljeća, a u kojoj se dotad funkcionalni proteini „lijepe“ na taj inicijalni „krivo“ strukturirani protein i tako stvaraju nakupine koje funkcionalno uništavaju neurone u kojima se nalaze (Slike 1 i 2). Interesantno je da u mehanističkom smislu na sličan način djeluju i prioni, proteinske infektivne čestice o kojima se ni danas puno ne zna, iako su svojevremeno izazivale prilično publiciteta zbog njihove povezanosti s nastankom spongiformnih encefalopatija poznatijih kao tzv. „kravlje ludilo“ odnosno Creutzfeldt-Jakobove bolesti u ljudi.
a)
b)
Nedavno sam pročitala izjavu jednog znanstvenika da kada imamo puno hipoteza znači da zapravo tapkamo u mraku, i ona bi se gotovo mogla primijeniti i ovdje, posebice na područje istraživanja potencijalnih lijekova za Alzheimerovu bolest budući da je u proteklih nekoliko godina velik broj vodećih farmaceutskih kompanija zatvorilo ovaj smjer istraživanja proglasivši ga, nakon milijuna uloženih dolara, neperspektivnim do nekog eventualnog prijelomnog otkrića ili neke nove paradigme.
Ipak, prve naznake o potencijalnom novom smjeru istraživanja neurodegenerativnih bolesti došle su iz područja neuroanatomije. Znanstvenici sa Sveučilišta u Ulmu, osim već poznatih karakterističnih agregata u mozgu, agregate alfa-sinukleina pronašli su i u živčanom sustavu pridruženom probavnom sustavu oboljelih od Parkinsonove bolesti. Predložili su hipotezu prema kojoj ova bolest zapravo započinje u crijevu te se putem još neidentificiranog patogenog agensa (najvjerojatnije alfa-sinukleina) širi kroz naš najduži i najrazgranatiji živac vagus do mozga gdje u konačnici uzrokuje propadanje u dijelu mozga gdje se nalaze neuroni koji luče dopamin. Kada razina dopamina padne ispod razine potrebne za pravilno funkcioniranje organizma, dolazi do vanjske manifestacije ove bolesti.1 U prilog hipotezi idu i istraživanja provedena na štakorima kojima je u eksperimentalnim uvjetima dan lizat mozga oboljelog od Parkinsonove bolesti, kao i neki od oblika rekombinantnog alfa-sinukleina te je pokazano kako su ovi proteini putovali putem vagusa do mozga štakora.2
No, ukoliko Parkinsonova bolest zaista započinje aberantnim nakupljanjem alfa-sinukleina u neuronima probavnog sustava – postavlja se pitanje kako i zašto se to događa? Jedna od hipoteza je da se alfa-sinuklein u živčanom sustavu oko probavila sintetizira i nakuplja kao naša vlastita odbrana od patogena, a do te se ideje došlo na temelju istraživanja zdrave djece koja su preboljela infekciju norovirusom a kod kojih je pronađena akumulacija alfa-sinukleina.3
Druga mogućnost je da su izvor prvog aberantnog proteina mikroorganizmi u našem probavnom sustavu. Nedavno je objavljeno nekoliko znanstvenih studija u kojima se Alzheimerova i Parkinsonova bolest povezuju s našim mikrobiomom. Povezanost mozga i probavnog sustava u tzv. osovinu „crijevo-mozak“ pomoću koje dolazi do njihove komunikacijske interakcije opisana je u nizu fizioloških i patofizioloških stanja. Sada se u ovu paradigmu pokušava integrirati i mikroorganizme koji nastanjuju naš probavni sustav. Njih tamo ima jako puno tako da brojčano nadmašuju broj naših stanica, a prema nekim izračunima kada bismo ih se riješili bili bismo i par kilograma lakši. Metode molekularne biologije omogućile su u zadnjih desetak godina iznimne proboje u području mikrobiologije tako da danas možemo gotovo u potpunosti sagledati sastav i međuodnos mikroorganizama koji se nalaze u našim crijevima što klasičnom mikrobiologijom nije bilo moguće. Slijedom takvih istraživanja, uspoređen je sastav i međuodnos mikroorganizama u zdravih osoba u odnosu na one oboljele od različitih bolesti pa tako i Alzheimerove i Parkinsonove bolesti i uočene su statistički značajne razlike. Ideja vodilja ovakvih istraživanja mikrobioma u ovim ali i drugim bolestima jest da ukoliko postoje razlike u njegovom sastavu u zdravih u odnosu na bolesne, onda se možda upravo u tim diferencijalnim mikroorganizmima nalazi nešto što je bitno za etiologiju ovih bolesti.
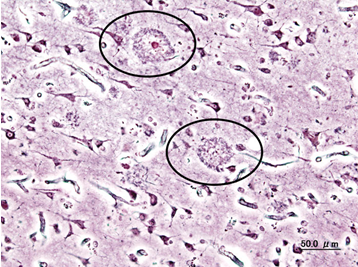
Dakle, ne radi se o patogenima koji uzrokuju akutne infekcije, već o mikroorganizmima koji žive s nama u suživotu. Kako bi onda ti mikroorganizmi mogli utjecati na naš organizam? Ove bakterije također posjeduju genetski materijal temeljem kojeg proizvode komponente koje su im potrebne za život a smatra se da proizvode i neke spojeve koji prelaze u naš krvotok, pa čak prolaze i našu krvno-moždanu barijeru, te utječu na naš središnji živčani sustav.4 Jako pojednostavljeno, bakterije šalju signale našem mozgu kojima nastoje izmanipulirati reakcije organizma koje su povoljne za njihov opstanak, bilo da unosimo hranu koja im se sviđa, ili da ih naš imunološki sustav zaobiđe, mogućnosti su ogromne, a naše trenutne spoznaje su tek vršak sante leda koja će možda biti razotkrivena u desetljećima koja dolaze. U kontekstu Alzheimerove i Parkinsonove bolesti stoga se pojavila hipoteza kako bi prvi aberantni proteini kojima bi se inicirao daljnji domino-efekt nakupljanja mogli biti zapravo porijeklom od mikroorganizama i to možda upravo onih po kojima se oboljeli razlikuju u odnosu na zdravu populaciju. Ako se prebacimo na primjer Alzheimerove bolesti, pokazano je da bakterije također mogu sintetizirati proteine nalik amiloidu-beta te je moguće da upravo taj prvi aberantni protein potječe od neke bakterije iz našeg probavnog sustava. Ovakvom molekularnom mimikrijom bakterijski amiloidi zapravo djeluju poput prionskih proteina jer siju inicijalno sjeme aberantnog proteina (bilo da se radi o mimikriji proteina koji nalikuje proteinu tau, amiloidu-beta ili alfa-sinukleinu u slučaju Parkinsonove bolesti) na koji se onda „lijepe“ naši proteini i taj domino-efekt se širi kroz desetljeća iz našeg probavnog sustava putem vagusa u centralni živčani sustav gdje izaziva upalu i odumiranje neurona (Slike 3 i 4).5
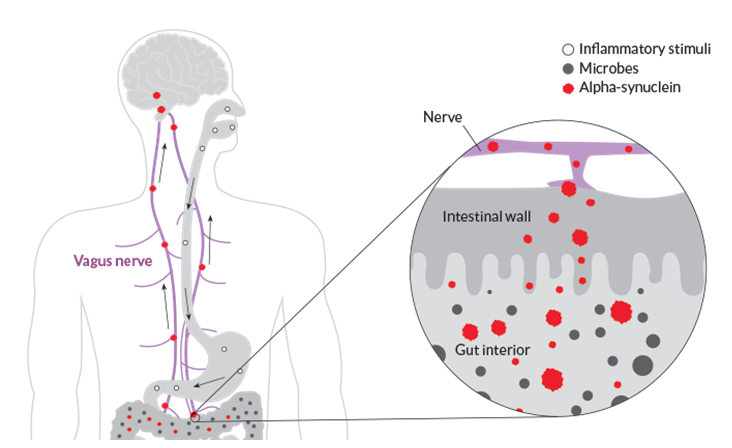
Treća mogućnost je zapravo kombinacija dvije prethodne ideje prema kojoj bi se kod osoba u kojih postoji nekakav otklon u sastavu mikrobioma u odnosu na zdravu populaciju mogla pojaviti povećana propusnost crijevne barijere koja bi izazvala upalnu reakciju na razini čitavog organizma te kroz vrijeme omogućila i propusnost krvno-moždane barijere i izazvala neuroinflamaciju, oštećenje neurona te u konačnici i neurodegeneraciju.
I na kraju kao prilog mikrobiomskoj paradigmi nastanka neurodegenerativnih bolesti možemo dodati i otkriće s početka ove godine prema kojem je po prvi puta u mozgu oboljelih od Alzheimerove bolesti pronađena DNA bakterije P. gingivalis koja je inače stanovnik plakova u našim ustima te je do danas bila povezivana s prvenstveno s periodontalnom bolesti. Što ova bakterija radi u našem mozgu kako je tamo uopće dospjela i ima li ikakve veze s nastankom Alzheimerove bolesti pokazat će buduća istraživanja, no dobro je da se u znanosti nekako uvijek dogodi da kada se zatvore jedna vrata, negdje ipak otvori prozor za neke nove ideje i potencijalne smjerove istraživanja.6 Znanstveni optimizam je naravno neumoran, i tko zna, možda ćemo jednoga dana ukoliko se ove hipoteze pokažu točnima, moći razviti i terapije kojima bi se ove bolesti zaustavile u ranoj fazi.
1) Braak H, Rub U, Gai WP, Del Tredici K (2003). Idiopathic Parkinson’s disease: possible routes by which vulnerable neuronal types may be subject to neuroinvasion by an unknown pathogen. J Neural Transm 110:517–536
2) Holmqvist S, Chutna O, Bousset L, Aldrin-Kirk P, Li W, Björklund T, Wang Z-Y, Roybon L, Melki R, Li J-Y (2014). Direct evidence of Parkinson pathology spread from the gastrointestinal tract to the brain in rats. Acta Neuropathol 128(6):805–820
3) Stolzenberg E, Berry D, Yang D, Lee EY, Kroemer A, Kaufman S, Wong GCL, Oppenheim JJ, Sen S, Fishbein T, Bax A, Harris B, Barbut D, Zasloff MA (2017). A Role for Neuronal Alpha-Synuclein in Gastrointestinal Immunity. J Innate Immun 9(5):456-463
4) Logsdon AF, Erickson MA, Rhea EM, Salameh TS, Banks WA. Gut reactions: How the blood-brain barrier connects the microbiome and the brain (2018). Exp Biol Med 243(2):159-165
5) Friedland RP, Chapman MR (2017). The role of microbial amyloid in neurodegeneration. PLoS Pathog. 2017;13:e1006654.